
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кінетика процесу абсорбції
|
|
|
|
Вступ
АБС0РБЦІЯ
Абсорбція - це поглинання газів або парів з газових або парових сумішей рідкими поглиначами, що називаються абсорбентами. Зворотній процес виділення рідкого поглинача з суміші газів називають десорбцією. Десорбцію газів проводять відгонкою його в струмі інертного газу або водяного пару в умовах підігріву абсорбенту або зниження тиску над абсорбентом.
В промисловості абсорбцію використовують для вирішення наступних основних задач:
1) для отримання готового продукту - (наприклад, абсорбція SO3 в виробництві сірчаної кислоти, абсорбція HCL з отриманням хлороводневої кислоти, абсорбція оксидів азоту водою в виробництві азотної кислоти і т.д.); при цьому абсорбцію проводять без десорбції;
для виділення цінних компонентів з газових сумішей (наприклад, абсорбція бензолу з коксового газу; абсорбція ацетилену з газів крекінга або піроліза природного газу і т.д.); при цьому абсорбцію проводять з десорбцією;
для очистки газових викидів від шкідливих домішок (наприклад, очистка топочних газів від SO2, очистка від фтористих з'єднань газів, що виділяються при виробництві мінеральних добрив і т.д.). очистку газів від шкідливих домішок адсорбцією використовують також для технологічних газів, коли присутність домішок неприпустима для подальшої переробки газу (наприклад, очистка коксового і нафтового газів від H2S, очистка азотоводневої суміші для синтезу аміаку від СО2 і CO і т.д.). В цих випадках вилучаємі з газових сумішей компоненти звичайно використовують, тому їх виділяють десорбцією;
для суміші газів, коли в абсорбційних процесах (абсорбція десорбція) приймають участь дві фази - рідка і газова - і відбувається перехід речовини з газової фази в рідку (при абсорбції) або навпаки, з рідкої в газову (при десорбції), причому інертний газ і поглинач є лише носіями компонента відповідно в газовій і рідкій фазах в цьому смислі в масопереносі участі не приймають.
Апарати, в котрих проводять процеси абсорбції, називають абсорберами.
9.1 Рівновага в процесах абсорбції
Умовою рівноваги між газовою і рідкою фазами є рівновага температур і тиск обох фаз і рівність хімічних потенціалів для всіх компонентів в обох фазах.
При постійній температурі і тиску в фазах хімічний потенціал компонента, що розподіляється, пропорційний концентраціям його в фазах. Тому в стані рівноваги між концентраціями компонента, що розподіляється, в обох фазах встановлюється деяке співвідношення, що характеризується константою фазової рівноваги, котра рівна відношенню концентрації компонента, що розподіляється, в газовій фазі до його концентрації в рідкій фазі.
В загальному випадку константа фазової рівноваги залежить від тиску (Р), температури (Т) і концентрації компонента, що розподіляється, (х) в рідині: m=f(P,T,x)
Ця функція для деяких систем може бути розрахована, але в більшості випадків її знаходять дослідним шляхом.
В якості основного закону, що характеризує рівновагу в системах газ-рідина, звичайно використовують закон розчинності газів в рідинах, сформульований Генрі. Згідно до цього закону при банній температурі мольна доля газу в розчині (розчинність) пропорційна парціальному тиску газу над розчином:
х = р/Е (9.1.1)
або
p = Ex (91.2)
де p - парціальний тиск газу над розчином в мм рт. ст.; х - концентрація газу в розчині в мольних долях; Е - коефіцієнт пропорційності (коефіцієнт Генрі) в мм рт.ст..
Значення р і х, що задовольняють рівняння (9.1.2), мають місце при досяганні рівноваги між фазами; ці значення потрібно розглядати як рівноважні: р - парціальний тиск газу, що знаходиться в рівновазі з розчином, що має концентрацію х, або х - концентрація газу в розчині, що знаходиться в рівновазі з газом, в котрому парціальний тиск газу, що розглядається, дорівнює р.
Коефіцієнт Е залежить від природи речовини, що розчиняться, і температури:
 (9.1.3)
(9.1.3)
Де q - теплота розчинення газу в ккал/кмоль, R=1,987 ккал/кмоль·град. - універсальна газова постійна; Т - абсолютна температура розчинення в К; С - постійна, що залежить від природи газу і рідини і визначається дослідним шляхом. З рівняння (9.1.3) і рис.9.1.1 видно, що з ростом температури розчинність газів в рідинах зменшується.
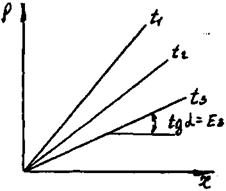
Рис.9.1.1. Залежність між розчинністю газу в рідині і парціальним тиском його над розчином при різних температурах t1>t2>t3 і відповідно Е1>Е2>Е3.
При розчиненні газу в рідині температура останньої звичайно збільшується внаслідок виділення значної кількості тепла.
Кількість тепла, що виділяється при. абсорбції, може бути знайдено як
Qаб =qдL(x1 - x2) (9.1.4)
де - qд - диференціальна теплота розчинення в межах зміни концентрації х1 - х2, ккал/кг; L - кількість абсорбенту, кг.
Якщо абсорбція проходить без відводу тепла, то можна допустити, що все тепло яке виділяється йде на нагрів рідини і температура останньої збільшується на величину
 (9.1.5)
(9.1.5)
де С - теплоємність розчину, ккал/(кг·град).
Парціальний тиск газу, що розчиняється, в газовій фазі, відповідаючий рівновазі, може бути замінений рівноважною концентрацією. Згідно закону Дальтона парціальний тиск компонента в газовій суміші дорівнює загальному тиску, помноженому на мольну долю цього компонента в суміші, тобто
р = Ру і у = р/Р, де Р - загальний тиск газової суміші;
у- концентрація газу, що розподіляється, в суміші в мольних долях. Співставляючи останню рівність з рівнянням (9.1.2), знайдемо
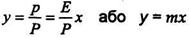 (9.1.6)
(9.1.6)
де m = Е/Р - константа фазової рівноваги
Рівняння (9.1.6) виражає залежність між рівноважними концентраціями газу, що розподіляється, в газовій і рідкій фазах. Якщо замінити в цьому рівнянні концентрації х і у, виражені в мольних долях, на X і У, виражені в відносних мольних долях, то, маючи на увазі співвідношення
 ,
, 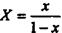 ,
,  ,
, 
рівняння (9.1.6) можна переписати як:
 (9.1.7)
(9.1.7)
При незначних концентраціях X величина (1-т)Х ≈ 0 і рівняння (9.1.7) набуває більш простого вигляду:
Y=mХ (9.1.8)
тобто при низьких концентраціях закон Генрі зображується прямою лінією.
Для добре розчинних газів, при великих концентраціях, розчинність менше, ніж випливає з закону Генрі.
Для систем, що не підпорядковуються цьому закону, коефіцієнт т в рівнянні (9.1.7) є змінною величиною, лінія рівноваги являє собою криву, котру звичайно будують по дослідним даним.
Якщо розчин є ідеальним і лише в газовій фазі спостерігається відхилення від ідеального стану, то в цьому випадку компоненти розчину не діють один на одного, Тому концентрація даного компонента в газовій фазі залежить лише від концентрації його в рідині (при постійній температурі і тиску). Тоді до кожного компоненту і можливо використовувати рівняння (9.1.8):
Yi = mXi , (9.1.9)
в котрому константа фазової рівноваги т залежить лише від температури і загального тиску в системі.
Тому, при постійній температурі рівновага даного компоненту і в розбавленому розчині на діаграмі У - X представляється прямою лінією з нахилом, тангенс котрого дорівнює mi.
Механізм абсорбції - це молекулярна та конвективна дифузії. Основне рівняння абсорбції має наступний вигляд:
My=Ky·ΔY·F, (9.2.1)
Mx=Kx·ΔX·F, (9.2.2)
де Ку - коефіцієнт масопередачі або абсорбції
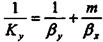 . (9.2.3)
. (9.2.3)
де 1/Ку - опір абсорбції;
1/βy - опір в фазі G;
m/βχ - опір в фазі L.
В абсорбції при дуже малих т, тобто добре розчинних газів величина т/βх дуже мала, тобто опором в рідкій фазі можна знехтувати.
Для погано розчинних газів можна знехтувати опором газової фази, тоді Ky≈βy, Ky≈βx/m, Ky≈βx (9.2.4)
При хімічній реакції є вплив на кінетику та рівновагу процесу. Чим вище швидкість реакції, тим вище швидкість абсорбції, цього можна досягти збільшуючи коефіцієнт βх. В цьому випадку рівняння масопередачі може бути записане:
М = β'Х ·ΔХ·Т
де β'χ = ǽ·βχ - коефіцієнт масовіддачі в рідкій фазі при абсорбції.
ǽ - коефіцієнт прискорення абсорбції при протіканні хімічної реакції.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 500; Нарушение авторских прав?; Мы поможем в написании вашей работы!