
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отбор среди мутантов, резистентных к антибиотикам
|
|
|
|
Этот метод отбора применяют в селекции продуцентов антибиотиков. Различные антибиотики имеют разный механизм действия на микробную клетку: некоторые - ингибиторы белкового синтеза, другие - мембранотропные или ДНК - тропные агенты. Получают резистентные к антибиотикам мутанты без мутагенной обработки путём высева суспензий спор или клеток на среды, содержащие различные концентрации антибиотиков. Антибиотики могут индуцировать у выживающих колоний появление морфологических мутантов, а также большую изменчивость по признаку антибиотикообразования. Селекцию с применением антибиотиков проводят в несколько этапов, постепенно повышая концентрацию препарата.
Отбор среди морфологических мутантов
Этот вид отбора основывается на частых фактах обнаружения морфологических изменений у высокопродуктивных штаммов, отобранных только по количественному признаку. Продуктивные штаммы часто оказываются малоспорулирующими или имеют повышенную споруляцию, они могут потерять пигмент или приобрести новый, могут изменить величину или форму колоний. Среди колоний, выживших после мутагенного воздействия, отбирают подряд морфологически изменённые, и проверяют их на продуктивность.
Основная цель использования всех описанных методов – сузить диапазон поиска «нужной» мутации, сделать этот поиск менее трудоёмким и более осознанным по сравнению со ступенчатым отбором случайных мутаций.
Метод получения генетических рекомбинантов
В селекции продуцентов биологически активных веществ генетические рекомбинанты пока не нашли широкого применения, что связано с отсутствием у большинства микроорганизмов - продуцентов биологически активных веществ систем генетического обмена.
В последние годы разработан метод получения генетических рекомбинантов на основе слияния протопластов, он доступен для многих микроорганизмов поэтому этот метод гибридизации снова привлёк внимание.
Достоинство метода - возможность совмещения в одном геноме различных мутаций из разных родительских штаммов, из разных видов и даже родов. Уже есть примеры использования метода в селекции продуцентов аминокислот и антибиотиков.
Для тех микроорганизмов, у которых есть системы генетического обмена, этот метод внедряется более успешно.
Все описанные методы называются традиционными, так как появился новый перспективный метод генной инженерии, но они не устарели и по-прежнему широко применяются. Вместе с тем у промышленных микроорганизмов всё шире проводится поиск плазмид и предпринимаются попытки их использования в качестве векторов при переносе генетического материала, его клонирования и амплификации. Эти исследования приближают промышленные микроорганизмы к объектам генной инженерии.
Вопросы для самопроверки
1.Использование достижений генной и клеточной инженерии
2. Значение микроорганизмов как объектов биотехнологических производств
3. Своеобразие и скорость обмена веществ у микроорганизмов
4. Теоретические основы процесса селекции
5. Выбор исходного микроорганизма для селекции
6. Подготовка селекционного материала к селекционной работе
7. Получение мутантов. Отбор положительных мутантов
8. Основные манипуляции генной и клеточной инженерии
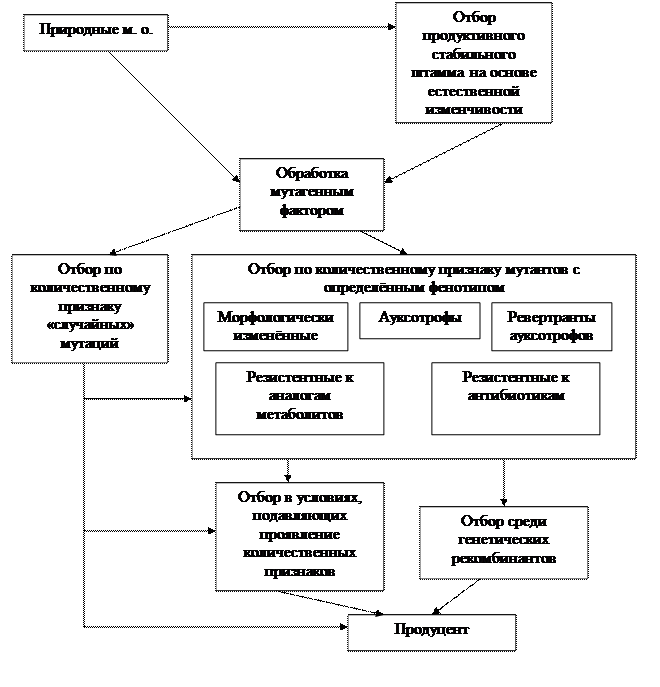
| Рисунок 2 - Схема селекционной работы |
Лекция 3. Общая характеристика биотехнологических производств. Типовая технологическая схема. Стадии биотехнологического производства
Форма проведения лекции: проблемная
План лекции
1. Общая характеристика биотехнологических производств
2. Типовая технологическая схема
3. Стадии биотехнологического производства
1. В биотехнологии существуют 3 основные технологии:
- ферментация (культивирование) – это процесс биохимических превращений в питательной среде под действием ферментов микроорганизмов, которые растут и размножаются в питательной среде, образуя метаболиты – продукты биосинтеза. Конечным продуктом может являться либо сама биомасса (хлебопекарные, кормовые дрожжи, вакцины, закваски), либо метаболиты (витамины, ферменты, спирт, кислоты, антибиотики и т.д.);
- энзиматические технологии - это процесс биохимических превращений под действием ферментов, без участия живых микроорганизмов;
- биотрасформация – неполное превращение органических соединений ферментами микроорганизмов, которые выполняют роль химических реагентов в органической химии. При этом в среде накапливаются продукты этого превращения – какие - то новые органические вещества.
Выбор той или иной технологии определяется рядом обстоятельств:
- экономика процесса;
- возможность получения данного продукта;
- специфичность действия ферментов;
- использование асептических условий;
- экология процесса и т. д.
Важнейшей задачей любого биотехнологического процесса является разработка и оптимизация научно-обоснованной технологии и аппаратуры для него. При организации биотехнологических производств частично был заимствован опыт развитой к тому времени химической технологии. Однако биотехнологические процессы имеют существенное отличие от химических в силу того, что в биотехнологии используют более сложную организацию материи – биологическую. Каждый биологический объект (клетка, фермент и т. д.) – это автономная саморегулирующаяся система. Природа биологических процессов сложна и далеко не выяснена окончательно. Для микробных популяций, например, характерна существенная гетерогенность по ряду признаков – возраст, физиологическая активность, устойчивость к воздействию неблагоприятных факторов среды. Они также подвержены случайным мутациям, частота которых составляет от 10-4 до 10-8. Гетерогенность также может быть обусловлена наличием поверхностей раздела фаз и неоднородностью условий среды.
2.В общем виде любой биотехнологический процесс включает три основные стадии: предферментационную, ферментационную и постферментационную. Принципиальная схема реализации биотехнологических процессов в общем виде может быть представлена блок-схемой, в которой сделана попытка охватить все варианты ферментационных процессов
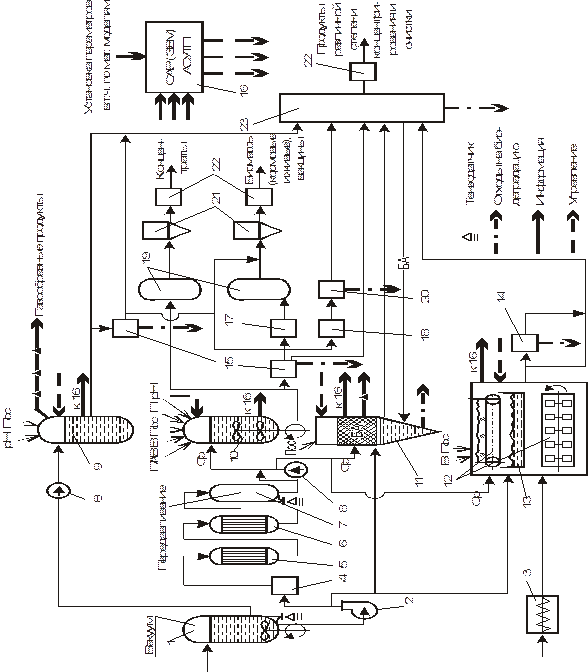
1 – реактор для приготовления сред, 2 – вихревой насос, 3 – аппарат для приготовления твердых сред, 4 – паровая колонка для подогрева сред до температуры стерилизации, 5 – выдерживатель сред при температуре стерилизации, 6 – теплообменник для охлаждения сред, 7 – мерник – сборник питательной среды,
8 – дозатор, 9 – анаэробный ферментер, 10 – глубинный аэробный ферментер, 11 – биокаталитический реактор, 12 – ферментер для поверхностной твердофазной ферментации, 13 – то же для поверхностной жидкостной ферментации, 14 – экстрактор, 15 – сепаратор для отделения биомассы, 16 – система локальной автоматики, 17 – плазмолизатор биомассы, 18 – дезинтегратор биомассы, 19 – выпарная установка, 20 – фракционирование дезинтегратов, 21 – сушилка и другие аппараты для обезвоживания, 22 – аппаратура для расфасовки продукта, 23 – ионообменные колонны, аппараты для химических и мембранных методов выделения, центрифуги, фильтры, кристаллизаторы и др. устройства.
Условные обозначения: рН – раствор для коррекции рН, П – компоненты и среды для подпитки, Пос – посевной материал, В – сжатый воздух, ПАВ – пеногаситель, Ср – стерильная питательная среда, БА – биологический агент
Рисунок 3 - Принципиальная схема реализации биотехнологических процессов
3. На предферментационной стадии осуществляют хранение и подготовку культуры продуцента (инокулята), получение и подготовку питательных субстратов и сред, ферментационной аппаратуры, технологической и рециркулируемой воды и воздуха. Поддержание и подготовка чистой культуры является очень важным моментом предферментационной стадии, так как продуцент, его физиолого-биохимические характеристики и свойства определяют эффективность всего биотехнологического процесса. В отделении чистой культуры осуществляют хранение производственных штаммов и обеспечивают их реактивацию и наработку инокулята в количествах, требуемых для начала процесса. При выращивании посевных доз инокулята применяют принцип масштабирования, то есть проводят последовательное наращивание биомассы продуцента в колбах, бутылях, далее в серии последовательных ферментеров. Каждый последующий этап данного процесса отличается по объему от предыдущего обычно на порядок. Полученный инокулят по стерильной посевной линии направляется далее в аппарат, в котором реализуется ферментационная стадия. Приготовление питательных сред осуществляется в специальных реакторах, оборудованных мешалками. В зависимости от растворимости и совместимости компонентов сред могут быть применены отдельные реакторы. Технология приготовления сред значительно усложняется, если в их состав входят нерастворимые компоненты. В различных биотехнологических процессах применяются различные по происхождению и количествам субстраты, поэтому процесс их приготовления варьирует. Поэтому дозирование питательных компонентов подбирается и осуществляется индивидуально на каждом производстве в соответствии с Технологическим регламентом конкретного процесса. В качестве дозирующего оборудования при этом применяются весовые и объемные устройства, используемые в пищевой и химической промышленности. Транспорт веществ осуществляется насосами, ленточными и шнековыми транспортерами. Сыпучие компоненты подают в ферментеры с помощью вакуумных насосов. Часто применяют принцип предварительных смесей, то есть соли предварительно растворяют и затем транспортируют по трубопроводам, дозируя их подачу по объему. В силу исключительного разнообразия биотехнологических процессов и применяемых для их реализации сред, методов и аппаратуры рассмотрение данных элементов далее будет связано с конкретными биотехнологическими производствами.
Стадия ферментации является основной стадией в биотехнологическом процессе, так как в ее ходе происходит взаимодействие продуцента с субстратом и образование целевых продуктов (биомасс, эндо- и экзопродуктов). Эта стадия осуществляется в биохимическом реакторе (ферментере) и может быть организована в зависимости от особенностей используемого продуцента и требований к типу и качеству конечного продукта различными способами. Ферментация может проходить в строго асептических условиях и без соблюдения правил стерильности (так называемая «незащищенная» ферментация); на жидких и на твердых средах; анаэробно и аэробно. Аэробная ферментация, в свою очередь, может протекать поверхностно или глубинно (во всей толще питательной среды).
Культивирование биологических объектов может осуществляться в периодическом и проточном режимах, полунепрерывно с подпиткой субстратом. Постферментационная стадия обеспечивает получение готовой товарной продукции и также, что не менее важно, обезвреживание отходов и побочных продуктов. В зависимости от локализации конечного продукта (клетка или культуральная жидкость) и его природы на постферментационной стадии применяют различную аппаратуру и методы выделения и очистки. Наиболее трудоемко выделение продукта, накапливающегося в клетках. Первым этапом постферментационной стадии является фракционирование культуральной жидкости и отделение взвешенной фазы – биомассы. Наиболее распространенный для этих целей метод – сепарация, осуществляемая в специальных аппаратах – сепараторах, которые работают по различным схемам в зависимости от свойств обрабатываемой культуральной жидкости. Основные проблемы, возникают при необходимости выделения мелковзвешенных частиц с размером 0.5–1.0 мкм и менее (бактериальные клетки) и необходимостью переработки больших объемов жидкости (производство кормового белка, ряда аминокислот). Для повышения эффективности процесса сепарации применяют предварительную специальную обработку культуры – изменение рН, нагревание, добавление химических агентов. Для увеличения сроков годности биотехнологических продуктов производят их обезвоживание и стабилизацию. В зависимости от свойств продукта применяют различные методы высушивания. Сушка термостабильных препаратов осуществляется на подносах, ленточном конвейере, а также в кипящем слое. Особо чувствительные к нагреванию препараты высушивают в вакуум-сушильных шкафах при пониженном давлении и температуре и в распылительных сушилках. К стабилизации свойств биотехнологических продуктов ведет добавление в качестве наполнителей различных веществ. Для стабилизации кормового белка применяют пшеничные отруби, кукурузную муку, обладающие дополнительной питательной ценностью. Для стабилизации ферментных препаратов используют глицерин и углеводы, которые препятствуют денатурации ферментов, а также неорганические ионы кобальта, магния, натрия, антибиотики и др.
3.Стадии технологической схемы. Получение посевного материала
Посевной материал – это чистая культура, размноженная до такого количества, чтобы ею можно было засеять промышленный ферментер.
Приготовление посевного материала в зависимости от вида продукта, его физиолого – биохимических особенностей состоит из нескольких последовательных этапов: исходная культура (в пробирке) → выращивание на скошенной агаризованной среде (в пробирках) → выращивание в колбах на качалке на жидкой среде (одна - две стадии) → выращивание в посевном аппарате (инокуляторе) → накопление культуры микроорганизмов в малом ферментере → посевной материал.
Выращивание посевного материала производится по следующим стадиям:
- получение культуры микроорганизма в микробиологической лаборатории завода;
- выращивание посевного материала в малом посевном аппарате (вместимостью 300 л);
- выращивание дрожжей в большом посевном аппарате (вместимостью 3200 л);
- накопление культуры дрожжей в малом ферментаторе (вместимостью 50м3).
Первая стадия выращивания посевного материала осуществляется в заводской лаборатории. Исходную культуру размножают на скошенной агаризованной среде в пробирке в стерильных условиях при оптимальных составе питательной среды и режиме выращивания (рН, температура, длительность).
Выращенную культуру стерильно смывают водой с поверхности агаризованной среды в колбы Эрленмейера вместимостью 750 мл, содержащие 50 - 100 мл жидкой питательной среды. Колбы с культурой помещают на качалку, которая находится в термостатируемом помещении (28 - 30°С). Перемешивание культуры, которое осуществляется встряхиванием качалки (120 - 210 об/мин), увеличивает скорость роста культуры благодаря интенсификации массообмена. Продолжительность выращивания культуры в колбах на качалке составляет 18 - 36 ч. Эту стадию выращивания необходимо контролировать по морфологическим показателями микроорганизма. Наилучшие результаты дает культура, которая находится в стадии физиологической зрелости в конце логарифмической фазы роста.
На второй стадии выращивания посевного материала готовую культуру из колб стерильно переносят в посевной аппарат (инокулятор), в который предварительно вносят питательную среду и минеральные соли в определенных количествах. Посевной аппарат оснащен мешалкой, аэрирующим устройством, а также контрольно-измерительной аппаратурой для регулирования температуры, рН, уровня пены и т. д. Объем питательной среды в аппарате не должен превышать 60 % общего объема. Важное значение имеет количество внесенного в аппарат посевного материала. При малом количестве посевного материла требуется более длительный период инокуляции. Поэтому в посевной аппарат вносят обычно посевного материала 10 - 12 % от объема питательной среды.
Во время приготовления посевного материала в аппаратах необходимо поддерживать оптимальный режим культивирования. Для контроля регулярно отбирают пробы и проводят их микробиологический и биохимический анализ.
Культивирование продолжают до тех пор, пока в среде не накопится дрожжей или других микроорганизмов 14 - 20 г/л (в расчете на сухую массу). Обычно процесс длится 12 - 14 ч.
Третья стадия культивирования посевного материала осуществляется в посевном аппарате объемом 3,2 м3. Для этого все содержимое малого инокулятора перекачивается в аппарат большего объема, в котором находится простерилизованная питательная среда. Коэффициент перехода от одного аппарата к другому зависит от конкретных условий выращивания каждой культуры микроорганизмов. Если этот переход осуществляется в фазе экспоненциального роста, то коэффициент перехода по отношению к объему следующего аппарата равен обычно 10. Процесс выращивания длится 12 - 14 ч.
Четвертая стадия процесса осуществляется в аппарате объемом 50 м3. Перед приемом дрожжевой суспензии с предыдущей стадии в аппарате готовят питательную среду путем подачи питательной среды, растворов питательных солей и микроэлементов. Среду доводят до оптимальных значений рН и температуры, перекачивают засевные дрожжи с предыдущей стадии и начинают процесс выращивания при непрерывной аэрации и перемешивании. Процесс накопления дрожжей длится 10 - 12 ч. Когда концентрация абсолютно сухих дрожжей в среде составит 14 - 17 г/л, дрожжевую суспензию можно подавать в производственные ферментеры. Полученный посевной материал подвергают тщательному микробиологическому и биохимическому контролю, так как от его активности и чистоты зависит дальнейший производственный цикл.
В микробиологической технологии требуются большие количества сжатого воздуха или инертного газа как для собственно биосинтеза, так и для вспомогательных операций. По технологическим признакам системы подготовки воздуха можно разделить на 4 группы:
- подготовка и подача воздуха на ферментацию при аэробном культивировании;
- подготовка и подача инертных газов для отвода газообразных продуктов из культуральной жидкости при анаэробном культивировании;
- подготовка и подача транспортного сжатого воздуха для перекачивания суспензий микроорганизмов из одного аппарата в другой и для пневмотранспорта сыпучих продуктов;
- очистка воздуха или смеси газов, отводимых от всех видов технологического оборудования.
Воздух, подаваемый в ферментер, выполняет несколько функций:
- снабжает микроорганизмы кислородом;
- отводит газообразные продукты обмена;
- отводит теплоту, выделяемую микроорганизмами;
- создает однородность суспензии массы микроорганизмов;
- увеличивает скорость массопередачи и перемешивания жидкой среды.
Контроль процесса очистки воздуха
В системе очистки и стерилизации воздуха для контроля и регулирования процесса устанавливаются специальные приборы. Температура воздуха контролируется на входе и выходе холодильника, относительная влажность воздуха и температура определяются после нагревателя. Принцип действия автоматического контроля и регулирования параметров воздуха заключается в следующем. Если приборы регистрируют отклонение температуры на входе в головной фильтр, то специальные регуляторы изменяют подачу пара в нагреватель таким образом, чтобы температура воздуха соответствовала заданной по регламенту.

| Рисунок 4 - Технологическая схема очистки и стерилизации воздуха: 1 - фильтр предварительной очистки воздуха; 2 - турбокомпрессор; 3 – теплообменник - охладитель; 4 -влагоотделитель; 5 – теплообменник – нагреватель; 6 – головной фильтр; 7 - индивидуальный фильтр. |
Для стерилизации, как фильтров, так и воздушных трубопроводов применяют острый пар. Чтобы снизить давление пара на фильтрующие элементы применяют додачу пара в фильтр с двух сторон - на входе и выходе воздушного трубопровода. Пар должен поступать чистый и сухой с температурой 120°С при стабильном давлении.
Подготовка стерильного воздуха
Биотехнологическое производство требует большое количество воздуха для перемешивания, транспортировки сыпучих материалов и дыхание аэробных микроорганизмов. Для стерильных производств воздух тоже должен быть стерильным. Допускается в стерильном воздухе один микроорганизм на 1000 объектов. Обеспечить такую чистоту воздуха только с помощью одного метода не возможно, поэтому применяют несколько аппаратов соединенных последовательно, в которых воздух проходит разные виды обработки. Взятие воздуха производится из атмосферы через специальные трубы высотой до 100 м. (чем выше, тем воздух чище) предварительная очистка от пыли, на которых содержание основного количества микроорганизмов производится на масляных фильтрах. Затем воздух поступает в компрессор, где сжижается за счет выделения адиабатической теплоты. Воздух охлаждают в теплообменнике до 400С, далее в аппарате, из него выделяют сконденсированную воду, а воздух поступает на головной фильтр. Далее воздух проходит окончательную очистку, на абсолютном индивидуальном фильтре.
Вопросы для самопроверки
1. Общая характеристика биотехнологических производств
2. Типовая технологическая схема
3. Стадии биотехнологического производства
4. Какими общими чертами характеризуется биотехнологическое производство.
5. Подготовка стерильного воздуха
6. Контроль процесса очистки воздуха
7. Выращивание посевного материала
8. Стадия ферментации
9. Принципиальная схема реализации биотехнологических процессов
10. Предферментационная, ферментационная и постферментационная стадии
11. 3 основные технологии в биотехнологии
Лекция 4. Общая характеристика сырья для биотехнологических производств. Основные требования и ограничения к нему
Форма проведения лекции: лекция - консультация
План лекции
1. Общая характеристика сырья для биотехнологических производств
2. Приготовление и стерилизация питательных сред
3. Основные требования и ограничения к сырью
1. Субстраты и среды, используемые в биотехнологии, весьма разнообразны, и их спектр непрерывно расширяется. С развитием промышленных процессов происходит накопление новых видов отходов, которые могут быть обезврежены и конвертированы в полезные продукты методами биотехнологии. С одной стороны, развивающиеся бурными темпами биотехнологические промышленные направления сталкиваются с проблемой исчерпания традиционных видов сырья, поэтому возникает необходимость в расширении сырьевой базы, с другой, – увеличение объемов накапливающихся отходов делает необходимым разработку нетрадиционных, в том числе биотехнологических способов их переработки. В настоящее время наблюдается рост интереса биотехнологов к природным возобновляемым ресурсам – продуктам фотосинтеза, биоресурсам мирового океана. В состав сред для биотехнологических процессов входят источники углерода и энергии, а также минеральные элементы и ростовые факторы. В качестве источников углерода и энергии в биотехнологических процессах используют главным образом природные комплексные среды неопределенного состава (отходы различных производств, продукты переработки растительного сырья, компоненты сточных вод и пр.), в которых помимо углеродных соединений содержатся также минеральные элементы и ростовые факторы. Довольно широко включены в разряд биотехнологических субстратов целлюлоза, гидролизаты полисахаридов и древесины. Последние около 30 лет используют для получения белка одноклеточных. Кислотный гидролиз древесины при 175–190°С обеспечивает выход в среду до 45–50 % редуцирующих веществ; при более жестких режимах гидролиза эта величина возрастает до 55–68 %. С большим успехом в последние годы стали применять гидролизаты торфа, это позволяет снизить стоимость, например, препаратов аминокислот в 4–5 раз. Минеральные элементы, необходимые для роста биологических агентов и входящие в состав питательных сред, подразделяются на макро- и микроэлементы. Среди макроэлементов на первом месте стоит азот, так как потребности в нем у биологических объектов на порядок превышают потребности в других элементах (фосфоре, сере, калии и магнии). Азот обычно используется микроорганизмами в восстановленной форме (мочевина, аммоний или их соли). Часто азот вводится в комплексе с другими макроэлементами – фосфором, серой. Для этого в качестве их источников используют соли (сульфаты или фосфаты аммония). Для ряда отдельных продуцентов, однако, лучшими являются нитраты или органические соединения азота. Существенное значение при обеспечении азотного питания продуцента имеет не только вид, но концентрация азота в среде, так как изменение соотношения C:N, воздействуя на скорость роста продуцента, метаболизм, вызывает сверхсинтез ряда целевых продуктов (аминокислот, полисахаридов и др.). Минеральные элементы необходимы для роста любого биологического агента, но их концентрация в среде в зависимости от биологии используемого биообъекта и задач биотехнологического процесса различна. Так, концентрация макроэлементов в среде (K, Mg, P, S) обычно составляет около 10–3–10–4 М. Потребности в микроэлементах невелики, и их концентрация в средах существенно ниже – 10–6–10–8 М. Поэтому микроэлементы часто специально не вносят в среде, так как их примеси в основных солях и воде обеспечивают потребности продуцентов. Отдельные продуценты в силу специфики метаболизма или питательных потребностей нуждаются для роста в наличие в среде ростовых факторов (отдельных аминокислот, витаминов и пр.). Помимо чистых индивидуальных веществ такой природы, на практике часто используют в качестве ростовых добавок кукурузный или дрожжевой экстракт, картофельный сок, экстракт проростков ячменя, зерновых отходов и отходов молочной промышленности. Стимулирующее действие данных ростовых факторов во многом зависит от индивидуальных свойств применяемого продуцента, состава основной среды, условий ферментации и др. Добавление ростовых факторов способно увеличить выход целевого продукта, например ферментов, в десятки раз.
Биотехнологическая продукция составляет миллионы тонн в год, поэтому сырья нужно много. 90 % сырья расходуется на производство спирта, а остальные 10 % - на все биотехнологические производства. Микроорганизм может использовать для жизни любое органическое соединение, поэтому весь мировой запас органики (растения, почва, химикаты) потенциально является пищей для микроорганизмов.
Однако для того, чтобы продуцент производил нужный продукт, ему необходимо индивидуальное питательное соединение (питательная среда).
Питательная среда является сложной трёхфазной системой и как бы продолжением микробной клетки.
Кроме индивидуальных органических соединений, в промышленности используют различные отходы. Например: 1 тонна кукурузного крахмала стоит 64-91 $, меласса - 140 $, этанол- 430 $, глюкоза- 290 $, сахароза- 629 $.
Всё сырьё можно разделить на несколько групп.
- Углеродсодержащее сырьё – глюкоза, сахароза, лактоза, крахмал, спирты, органические кислоты и т. д.
Глюкоза - С6H12O6 кристаллическая, может содержать воды не более 9 %, золы - не более 0,07 %, (в том числе не более 0,004 % железа). В сухом веществе должно быть не менее 99,5 % редуцирующих веществ.
Сахароза - (свекловичный сахар, тростниковый сахар) С12H22O11 техническая содержит не менее 99,75 % сахарозы, не более 0,003 % золы. Влажность до 0,15 %.
Лактоза – (молочный сахар) С12H22O11, получаемая из молочной сыворотки, является отходом при изготовлении масла и сыра. После сгущения до концентрации сахаров 50 % и кристаллизации получают концентрат лактозы.
Лактозный сахар – сырец содержит не менее 92 % сахара, не более 3 % воды, 2 % золы и 1 % молочной кислоты. Количество белка не регламентировано, но обычно оно не превышает 3 %.
Крахмал представляет собой смесь полисахаридов, встречающихся в растениях в виде зерен (запасной углевод растений). Получают в промышленном масштабе из картофеля и кукурузы. Под действием ферментов микроорганизмов крахмал гидролизуется до глюкозы. В зависимости от сорта (высший, I, II, III) содержание золы в крахмале достигает 0,35 - 1,2 %.
Метиловый спирт (метанол) CH3OH представляет собой бесцветную, легкоподвижную жидкость, по запаху напоминающую этиловый спирт. Хорошо растворяется в воде, легко усваивается многими микроорганизмами. Метиловый спирт может быть получен из природного газа, нефти, каменного угля. Перспектива использования метилового спирта во многом зависит от эффективности способа его получения.
Следует помнить, что метиловый спирт - сильный яд для человека. Приём внутрь 30 мл. метилового спирта смертелен.
Этиловый спирт (этанол) С2H5OH является перспективным сырьём для выращивания микроорганизмов. Этиловый спирт хорошо смешивается с водой, нетоксичен, получаемая на нём биомасса не требует специальной очистки. В качестве источника углерода могут использоваться все марки этилового спирта, получаемого как микробиологическим, так и химическим путём. В этиловом спирте допускается присутствие незначительных количеств изопропилового спирта, серусодержащих соединений, органических кислот, сложных эфиров, диэтилового эфира, нерастворимых в воде веществ.
Уксусная кислота CH3COOH с содержанием основного вещества не менее 60 %, а формальдегида HCHO и муравьиной кислоты HCOOH - не более 1 % может быть использована в качестве источника углерода.
К этой же группе относятся различные отходы и побочные продукты: меласса, зерновая и картофельная барда, кукурузная мука, мелассная барда, ацетонобутиловая барда.
Меласса - побочный нестандартный продукт сахарной промышленности, который остаётся после второго отделения кристаллов сахара. Цвет – тёмно – коричневый, плотность 1,35 - 1,40 г/см3. Меласса содержит 61- 68 % сухих веществ, 40 - 55 % сахарозы. Кроме того, в ней имеется 0,5 - 2,0 % инвертного сахара и 0,5 - 2,5 % раффинозы. В мелассе содержится 1,1 - 1,5 % азота, причем третья часть его находится в форме бетаина, использовать который микроорганизмы не могут. В состав мелассы входят многие аминокислоты (аспаргиновая, глутаминовая, лейцин, изолейцин, тирозин) и витамины группы В (биотин, рибофлавин, инозит, никотиновая и пантотеновая кислоты). Особенно большое значение имеет биотин (его содержание - 80 мг/т).
В мелассной золе много калия (30 - 40 %), магния (1,5 - 4,5 %), кальция (до 14 %), железа и других элементов, но сравнительно мало фосфора. При хранении мелассы могут иметь место потери сахара в результате деятельности микроорганизмов.
Кукурузная мука. Состав кукурузной муки может колебаться в значительных пределах в зависимости от сорта кукурузы, условии её выращивания и хранения. В среднем она содержит 67 - 70 % крахмала, около 10 % других углеводов (клетчатки, пентозанов, декстринов, растворимых углеводов), около 12 % белков (30 % глютелина и 45 - 50 % казеина). Влажность не должна превышать 15 %. Содержание золы примерно 0,9 %. Зола кукурузной муки содержит до 45 % фосфорного ангидрида, 30 % оксида калия и 15 % оксида магния. Кукурузная мука служит источником углерода в питательных средах для биосинтеза антибиотиков и ферментов. Она является самым дешевым продуктом из всех зерновых, и её цена зависит от степени измельчения.
Мелассная барда является нестандартным продуктом, отходом спиртового производства. Содержание сухих веществ в натуральной барде 6 - 10 %. В составе барды кроме дрожжевой массы присутствуют аминокислоты, гликолевая, молочная, янтарная кислоты, соли кальция, калия, натрия, марганца, кобальта, меди и ряд витаминов группы В.
Ацетонобутиловая барда - нестандартный продукт, являющийся отходом микробиологического производства органических растворителей - ацетона и бутилового спирта. Для микробиологического синтеза используют барду после отделения шлама. В составе барды имеются углеводы, клетчатка, азотсодержащие и зольные вещества.
- Углеводородсодержащие сырье - это парафины нефти, метан (сырьё дешевое, и имеет постоянный состав, что очень хорошо для автоматизации процессов).
- К Нетрадиционным источникам сырья относится метанол, этанол и т. д.
Эти три группы – основной компонент питательной среды то есть углеродсодержащий. Кроме этого в состав питательной среды должны входить:
- источники минерального питания (соли фосфора, азота, натрия, калия, магния, кальция и т. д. содержащие АТФ);
- микроэлементы (цинк, марганец, молибден, кобальт, сера и т. д.);
- комплексные обогатители сред. Они содержат биологически активные вещества (БАВ) – витамины, гормоны, ферменты, факторы роста.
Эти вещества вводят не в чистом виде, а в составе каких-то природных смесей, например: кукурузный экстракт, экстракт солодовых ростков, дрожжевой автолизат и т. д.
Питательные среды бывают:
- синтетические - они составляются строго по регламенту только из чистых органических и неорганических веществ, то есть их состав полностью известен, применяют только в лабораториях;
- природные среды - составляются из любых отходов и полупродуктов, получаются более дешевые среды, которые применяются в промышленности;
- полусинтетические среды - смесь первых и вторых.
2. Принципы составления питательных сред. Основной принцип составления питательной среды - это удовлетворение физических потребностей микроорганизмов. Каждый конкретный микробиологический процесс имеет свои особенности на стадии приготовления питательных сред, и это связано с применяемым в данном производстве источником углерода. Растворимые источники углерода (например, сахара) предварительно растворяют в воде, доводя растворы до определенной концентрации в небольших открытых реакторах с мешалками, а затем подают в закрытый реактор – смеситель с плоским дном, снабженный для ввода пара барботажным устройством. Нерастворимые источники углерода тщательно суспендируют в воде в реакторе с мешалкой и переводят в суспензию в реакторе - смесителе. Крахмалосодержащее сырьё предварительно клейстеризуют. Минеральные соли растворяют в реакторе с мешалкой, а перед подачей в реактор - смеситель фильтруют для удаления шлама (гипс и другие нерастворимые осадки). Раствор микроэлементов обычно готовится отдельно. В реакторе - смесителе все поданые в необходимых количествах компоненты тщательно перемешиваются, рН среды доводится до необходимого значения подачей аммиачной воды или кислоты. Реакторы для приготовления питательной среды должны быть снабжены достаточно мощными мешалками, а также перегородками - отражателями, не допускающими завихрения и вращения жидкости. В зависимости от состава используемой питательной среды выбирают тип перемешивающего устройства как в аппаратах для подготовки различных источников углерода (растворение сахаров, разбавление мелассы, клейстеризация крахмала и т. п.), так и в самом реакторе - смесителе для приготовления питательной среды. Приготовленная в реакторе - смесителе питательная среда должна быть подвергнута стерилизации. Для стерилизации питательных сред используют два метода: при периодическом культивировании - циклический и при непрерывном культивировании - непрерывный.
Циклический метод стерилизации питательной среды очень прост. Это операцию можно осуществлять непосредственно в ферментере. При этом среда и оборудование стерилизуются одновременно. Чаще всего используют комбинированный нагрев острым и глухим паром. Острый пар подают в питательную среду, а глухой - в рубашку (или змеевик). Острый пар поступает в ферментер через штуцеры для подачи посевного материала, воздуха и для взятия проб. Поэтому вся арматура, соединенная с ферментером, стерилизуется проходящим острым паром. Так как обработка питательной среды острым паром приводит к образованию конденсата, необходимо заранее учитывать разбавление среды конденсатом и вносить соответствующую поправку в рецептуру приготавливаемой среды. Тогда к концу стерилизации среда будет иметь необходимую концентрацию всех питательных компонентов. При циклической стерилизации поддерживают температуру 121оС, что соответствует давлению насыщенного пара 100 кПА. Обычно питательные среды выдерживают при такой температуре от 30 - 40 мин. Полный цикл нагревания, выдержки и охлаждения для ферментеров большого объёма достигает нескольких часов. Длительная тепловая стерилизация приводит к определенным химическим изменениям в составе питательной среды. Некоторые нестойкие к нагреванию соединения разлагаются, что приводит к потере необходимых для микроорганизмов питательных веществ. Другие соединения могут вступать во взаимодействие между собой с образованием продуктов, ингибирующих рост микроорганизмов. Большинство изменений химических компонентов в составе питательной среды может происходить при температурах, более высоких, чем температура стерилизации. Следовательно, эффективная стерилизация при минимальном изменении состава среды может быть достигнута применением более высокой температуры, быстрым нагреванием и охлаждением среды. Поэтому в настоящее время циклический метод применяют для стерилизации среды только в аппаратах малого объёма. Метод высокотемпературной непрерывной стерилизации, используемый на большинстве заводов, дает возможность свести к минимуму ухудшение питательных качеств среды без снижения эффективности самой стерилизации. При непрерывной стерилизации можно значительно сократить время стерилизации, а, следовательно, снизить расход пара. Кроме того, этот вид стерилизации легко поддается автоматизации. Для непрерывной стерилизации приготовленная в отдельной емкости питательная среда насосом прокачивается через установку в простерилизованный ферментер. Применение более высоких температур позволяет резко сократить продолжительность выдерживания среды при максимальной температуре, а периоды нагревания и охлаждения осуществить за несколько секунд. Если питательная среда не содержит суспендированных частиц, то температура 150 - 160 оС обеспечивает мгновенную стерилизацию. При наличии твердых суспендированных частиц в среде оптимальная для стерилизации температура должна быть ниже, так как требует более длительное время для прогревания таких частиц. В данном случае температура стерилизации составляет 135 оС, а длительность выдержки - от 5 до 15 минут.
3. К сырью для биотехнологических производств предъявляют ряд требований:
- оно должно обеспечивать образование требуемого продукта;
- среда должна быть доступной (для дешевых продуктов, а для очень дорогих можно применять дорогие среды);
- питательная среда должна обеспечить легкое выделение продукта;
- среда должна быть не токсичной и не загрязнять окружающую среду.
Традиционно состав питательной среды, оптимальной для биотехнологического процесса, определяется методом длительного эмпирического подбора, в ходе которого на первых этапах определяется качественный и количественный состав среды. Было сделано много попыток обоснования состава сред с позиций физиологии и биохимии продуцента, но так как потребности в питательных веществах видо- и даже штаммоспецифичны, в каждом конкретном случае приходится подбирать оптимальный для конкретного продуцента состав среды. В последние 20–25 лет все шире используют математический метод планирования экспериментов, математическое моделирование биотехнологических процессов; это позволяет обоснованно подходить к конструированию питательных сред сделать их экономичными.
Вопросы для самопроверки
1.Общая характеристика сырья для биотехнологических производств
2. Приготовление и стерилизация питательных сред
3. Основные требования и ограничения к сырью
4. Основные компоненты питательной среды
5. Периодическая или циклическая стерилизация
6. Непрерывная стерилизация
7. Принципы конструирования питательных сред
8. Основные виды сырья и их сравнительная характеристика
9. Математический метод планирования экспериментов для оптимизации питательных сред
10. Влияние состава питательных сред на экономику процесса в целом
Лекция 5. Первичные и вторичные метаболиты микроорганизмов. Характеристика дрожжей, молочнокислых бактерий, продуценты органических кислот, аминокислот, витаминов, ферментов, кормового белка, антибиотиков
Форма проведения лекции: лекция - конференция
План лекции
1. Первичные и вторичные метаболиты микроорганизмов
2. Характеристика дрожжей
3. Характеристика молочнокислых бактерий
4. Характеристика продуцентов органических кислот, пропионовокислые или пропионовые бактерии
5. Характеристика продуцентов аминокислот, витаминов, ферментов
6. Характеристика продуцентов кормового белка
7. Характеристика продуцентов антибиотиков
1. Промышленно важные продукты жизнедеятельности микроорганизмов по их природе и значению для самой микробной клетки делят на три основные группы:
- крупные молекулы (ферменты, полисахариды с молекулярной массой от 10 тыс. до нескольких миллионов);
- первичные метаболиты (соединения, необходимые микроорганизмам для роста: аминокислоты, пуриновые и пиримидиновые нуклеотиды, витамины и др.);
- вторичные метаболиты (соединения, ненужные микроорганизмам для роста: антибиотики, токсины, алкалоиды, факторы роста растений).
Первичные и вторичные метаболиты микробного происхождения обычно имеют довольно низкую по сравнению с ферментами молекулярную массу менее 1,5 тыс.
Биологическую активность эти вещества проявляют различно: удовлетворяют потребности человека и животных, взаимодействуют с микроорганизмами, насекомыми, растениями, участвует в разложении различных органических субстратов. Кроме того, некоторые аминокислоты могут служить сырьем для дальнейших превращений на основе химического синтеза.
Продукты микробного синтеза для того, чтобы стать объектом рентабельного промышленного производства, должны выделяться микробной клеткой в питательную среду и накапливаться в среде в количествах, которые оправдывали бы сырьевые и энергетические затраты на культивирование микроорганизма и выделение продукта в необходимой для дальнейшего использования форме.
2.Дрожжи, используемые для получения спирта, относятся в основном к роду Saccharomyces. Систематика рода Saccharomyces неоднократно подвергалась пересмотру, номенклатура видов часто изменялась в зависимости от позиций авторов, придерживающихся тех или иных концепций в систематике дрожжей.
В последнем руководстве по дрожжам к роду Saccharomyces отнесено семь видов, размножающихся вегетативно преимущественно в диплоидной фазе.: Sacch. cerevisiae, Sacch. kluyveri, Sacch. exiguus, Sacch. dairensis, Sacch. servazzii, Sacch. tellustris, Sacch. unisporus. Как синонимы Sacch. cerevisiae рассматриваются Sacch. bayanus, Sacch. carlsbergensis и ряд других промышленно важных дрожжей.
Наибольшее значение имеет Sacch. cerevisiae. К этому виду относятся расы дрожжей, используемые в хлебопечении, спиртовом производстве, пивоварении, виноделии, производстве кваса. Поэтому приводим характеристику вида. Saccharomyces cerevisiae Hansen. На солодовом сусле в трехсуточной культуре при 28 °С клетки имеют сферическую, эллипсоидальную или несколько удлиненную формы; располагаются единично или парами, иногда образуют короткие цепочки или мелкие грозди. В зависимости от размера клеток штаммы этого вида можно разделить на три морфологические группы. К первой группе относятся штаммы, имеющие самые крупные клетки (3,5-10,5 ´ 5,0-21,0 мкм), ко второй - с наименьшими (2,5- 7,0 ´ 11,0-19,0 мкм), к третьей - промежуточные (3,5-8,0 ´ 5,0-11,5-18,0 мкм). Некоторые штаммы образуют удлиненные клетки, достигающие 30 мкм и более. Колонии у этих дрожжей пастообразные, кремовые или коричневато-кремовые, обычно с довольно ровной, гладкой, иногда слегка пузырчатой или покрытой точками поверхностью, с блестящими или тусклыми секторами. Край колоний цельный, иногда лопастный, изредка образуется примитивный псевдомицелий. Аскообразование легко вызвать при высеве дрожжей на агар с ацетатом. Аски обычно содержат от одной до четырех спор шаровидной или эллипсоидальной формы. Сбраживает глюкозу, галактозу, сахарозу, мальтозу и на '/з раффинозу. В аэробных условиях использует глюкозу, галактозу, сахарозу, мальтозу, на '/з раффинозу. Способность к использованию L-сорбозы, трегалозы, мелецитозы, инулина, L-арабинозы, D-рибозы, глицерина, D-маннита, D-сорбита, a-метил-О-глюкозида и молочной кислоты варьирует. Не ассимилирует целлобиозу, лактозу, мелибиозу, крахмал, ксилозу, D-арабинозу, L-рамнозу, эритрит, рибит, дульцит, салицин, янтарную и лимонную кислоты, инозит. Не использует в качестве источника азота NO3-. Штаммы имеют различную способность расти на средах в отсутствие витаминов. В пищевой промышленности дрожжи, не принадлежащие к сахаромицетам, играют, как правило, отрицательную роль, нарушая ход технологического процесса и вызывая порчу сырья и готовой продукции. Характеристика родов этих дрожжей приводится в таблице. Штаммы Sacch. cerevislae подразделяют на расы низового и верхового брожения. К расам низового брожения относится большинство винных и пивных дрожжей, к расам верхового - спиртовые, хлебопекарные и некоторые пивные. Дрожжи низового брожения функционируют в производстве при температуре 6 - 10°С и ниже (до 0°С), а верхового - обычно при 14 - 25 °С. В конце брожения низовые дрожжи оседают на дно, формируя плотный осадок, верховые - всплывают на поверхность и образуют «шапку». Способность последних подниматься на поверхность обусловлена тем, что клетки после почкования остаются соединенными в небольшой цепочке; пузырьки углекислого газа поднимают их на поверхность. Оба свойства, однако, не абсолютны. По поведению в бродящей среде дрожжи разделяют также на хлопьевидные и пылевидные. В основе этого разделения лежит различие в их флокуляционных свойствах (флокуляция - обратимая агрегация, или агглютинация, клеток). Хлопьевидные дрожжи в конце брожения слипаются в комки («флокулы») и либо оседают на дно, либо поднимаются на поверхность. Пылевидные дрожжи в течение всего процесса брожения находятся во взвешенном состоянии. Флокулируют дрожжи как низового, так и верхового брожения. Клетки хлопьевидных дрожжей крупнее и тяжелее, чем пылевидных; последние особенно подвержены автолизу. Пылевидные дрожжи дают меньший прирост биомассы, но обладают более высокой бродильной активностью и полнее сбраживают сусло, образуют больше диацетила и высших спиртов. Хлопьевидные дрожжи лучше создают аромат напитков. Способность дрожжей к хлопьеобразованию не является стойким признаком, и штаммы могут ее постепенно утрачивать. Отбор новых рас дрожжей, как правило, проводят из ферментеров, в которых процесс брожения проходил с наиболее высокими показателями. Выделенные штаммы исследуют в лабораторных и производственных условиях. Расы, дающие наилучшие показатели брожения, становятся производственными и широко применяются в практике. Многие попытки селекционировать дрожжи бродильных рас при искусственном воздействии мутагенных факторов оканчивались неудачей. Мутанты, проявляющие ценные свойства в лабораторных условиях, обычно не выдерживали конкуренции в производственных условиях и вытеснялись.
В последние годы при селекции рас дрожжей для ряда отраслей промышленности (производство спирта из мелассы, хлебопечение) с успехом применяют метод гибридизации.
Методы генетической инженерии открывают новые пути для получения высокоэффективных рас дрожжей.
| Род | Вегетативное размножение | Форма клеток | Наличие псевдомицелия | Форма аскоспор | Способность к брожению | Ассимиляция нитратов | Потребность в витаминах |
| Brettanomyces | Почкование | Эллипсоидальная, яйцевидная, цилиндри- ческая, удлиненная | + | - | +/- | +/- | + |
| Brettanomyces | Почкование | Эллипсоидальная, яйцевидная, цилиндри- ческая, удлиненная | + | - | +/- | +/- | + |
| Hanseniaspora | Биполярное почкование | Лимоновидная овальная | + | Шляповидная, шлемовидная, шаровидная с бородавчатой поверхностью и ободком по центру | + | - | + |
| Hansenula | Многостороннее почкование | Сферическая, эллипсои- дальная, ци линдри- ческая | + (иногда истинный мицелий) | Шляповидная, полусферическая, сатурновидная | +/- | + | +/- |
| Pichia | То же | Сферическая, коротко- овальная цилиндри- ческая | + (иногда истинный мицелий) | Сферическая, шляповидная, сатурновидная | +/- | - | +/- |
| Schizosaccharomyces | Деление | Шаровидная, цилиндрическая | Истинный мицелий | Шаровидная, овальная | + | - | + |
| Saccharomycodes | Биполярное поч- кование | Лимоновидная, удлиненная | +/- | Шаровидная с гладкой поверх- ностью | + | — | + |
Таблица 6 – Характеристика рас дрожжей
3. Многие направления практического использования молочнокислых бактерий возникли в глубокой древности, когда человек стихийно начал применять их в повседневной жизни. Первые научные исследования этих микроорганизмов были проведены Л. Пастером; результаты их опубликованы в 1857 г. С тех пор молочнокислые бактерии постоянно привлекают к себе внимание исследователей. На основе их использования создаются и развиваются крупные отрасли народного хозяйства. Успешно разрабатываются также способы борьбы с теми молочнокислыми бактериями, которые наносят урон пищевой и бродильной промышленности. Основным свойством молочнокислых бактерий, позволяющим объединить их в одну физиологическую группу, является способность существовать за счет брожения, накапливая при этом в качестве главного продукта молочную кислоту. Молочнокислые бактерии, как правило, неподвижны, не образуют спор, положительно окрашиваются по Граму, не восстанавливают нитраты в нитриты, не образуют пигментов, обладают небольшой протеолитической активностью. Цитохромы и каталазу не образуют, но некоторые продуцируют пероксидазу разлагающую Н2О2. Молочнокислые бактерии делят на две большие группы - гомоферментативные и гетероферментативные. Гомоферментативные в результате брожения образуют главным образом молочную кислоту и лишь ничтожные количества других продуктов (летучих кислот, этилового спирта и углекислоты). Гетероферментативные, помимо молочной кислоты, образуют углекислый газ, уксусную кислоту и (или) этиловый спирт, используя на это до 50% сбраживаемых гексоз. Молочнокислые бактерии относят к родам Lactobacillus, Leuconostoc, Streptococcus и Pediococcus. Род Lactobacillus объединяет палочковидные бактерии, форма вторых весьма разнообразна - от коротких коккообразных до длинных нитевидных. Род, в соответствии с предложением Орла-Иенсена (1919, 1943), подразделяется на три подрода: Streptobacterium, Thermobacterium и Betabacterium. Они различаются рядом признаков. Например, термобактерии, в противоположность стрепто- и бетабактериям, растут при 45°С и не растут при 15°С, колонии чаще шероховатые, клетки длинные, нитевидные. Бетабактерии в отличие от двух других подродов образуют газ на средах с углеводами. Среди представителей рода Lactobacillus есть гомо- и гетероферментативные виды. Род Leuconostoc объединяет гетероферментативные кокковидные бактерии, которые бывают овальными или яйцевидными. Род включает виды Leuc. cremoris, Leuc. dextranicum, Leuc. lactis, Leuc. mesenteroides, Leuc. oenos. Лейконостоки по форме клеток иногда сложно отличить от гетероферментативных лактобацилл (бетабактерий). В таких случаях следует помнить, что их представители (не бетабактерии) часто сбраживают трегалозу, не образуют NН3 из аргинина и продуцируют D(—)-молочную кислоту из глюкозы. К роду Pediococcus относят гомоферментативные кокковидные бактерии. Деление их клеток происходит в двух плоскостях, в результате чего часто образуются тетрады или гроздья. Род включает виды Р. acidilactici, P. damnosus, P. dextranicum, Р. halophilus. Род Streptococcus объединяет гомоферментативные бактерии. сферической или овальной формы, делящиеся в одной плоскости и располагающиеся парами или цепочками. Стрептококки разделяют на фекальные, молочные, стрептококки ротовой полости (оральные) и пиогенные.
Таблица 7-Группы стрептококков
| Фекальные (энтерококки) | Молочные | Оральные | Пиогенные |
| S. avium S. bo vis S. durans S. equinus S. faecalis (с разновидно- стями S. faecalis subsp. liquefaciens и S. faecalis subsp. zymogenes) S. faecium S. faecium subsp. casseiiflavus | S. cremoris S. lactis S. lactis subsp. diaceti- lactis S. raffinolactis S. thermophilus | S. milleri S. mitior S. mutans S. salivarius S. sanguis | S. acidominimus S. agalactiae S. anginosus S. disgalactiae S. equi S. equisimilis S. pyogenes S. иberis S. zooepidemicus |
Многие виды молочнокислых бактерий растут не только в анаэробных условиях, но и при доступе молекулярного кислорода. Однако в присутствии 02 у них не происходит переключения с брожения на аэробное дыхание и не изменяется способ синтеза АТФ (только путем субстратного фосфорилирования). Поэтому молочнокислые бактерии относят к категории аэротолерантных анаэробов. Характерное свойство молочнокислых бактерий - высокая спиртоустойчивость: некоторые виды могут расти на средах с 15 - 18% этилового спирта, а единичные - даже при 24%. Способность расти в средах с низким значением рН также свойственна этим микроорганизмам: многие растут при рН от 5,5 до 8,8, некоторые при рН 2,9 - 3,2. Это дает им возможность преобладать в кислых субстратах. Границы температур, в которых возможна жизнедеятельность молочнокислых бактерий, довольно широки. Для многих видов оптимальная температура 30—40°С, но имеются и термофилы, растущие при 50°С и выше. Некоторые молочнокислые бактерии способны расти при сравнительно низкой температуре (до 3°С). По потребности в питательных веществах молочнокислые бактерии относятся к наиболее сложным микроорганизмам. Из соединений углерода могут использовать незначительное количество веществ, служащих бактериям источником энергии (моно- и дисахариды, органические кислоты).

Рисунок 5 - Электронно-микроскопические фотографии клеток, выращенных в жидкой среде. А - Lactobacillus coryniformis subsp. coryniformis, ´ 7500; Б - L. curvatus, ´ 24 000; B - L. brevis, ´ 7800; Г - L. cellobiosus, ´ 7800; Д, Е - L. coprophilus, ´ 7800.
Молочнокислые бактерии, как правило, нуждаются в сложных органических соединениях азота. Они растут на средах с подобранными смесями аминокислот, ферментативными или кислотными гидролизатами белков - мяса, лактальбумина, казеина, различных сортов муки. Потребность в наборе и количестве отдельных аминокислот варьирует у различных видов. Большинству необходимы аргинин, цистеин, глутаминовая кислота, лейцин, фенилаланин, триптофан, тирозин, валин. Только некоторые молочнокислые бактерии (стрептококки) могут расти на средах, содержащих аммонийные соли в качестве единственных источников азота. Большинству молочнокислых бактерий необходимы витамины (рибофлавин, тиамин, пантотеновая, никотиновая, фолиевая кислоты, пиридоксаль и др.). Этим в значительной мере объясняется влияние на рост бактерий добавок к средам различных растительных экстрактов (картофель, морковь, кукуруза и др.), дрожжевого автолизата и других витаминсодержащих соединений. Выраженная потребность отдельных штаммов молочнокислых бактерий в определенных витаминах и аминокислотах используется для определения этих соединений в разнообразных средах до восьми витаминов и до восемнадцати аминокислот). Рост молочнокислых бактерий стимулируют и некоторые пептиды,пурины (аденин, гипоксантин, гуанин) и пиримидины (урацил, тимин и др.), жирные кислоты (уксусная, олеиновая), а также лимонная кислота (часто вводится в среды для выращивания бактерий).
4. Способность продуцировать ту или иную кислоту – широко распространенное среди микроорганизмов свойство. В качестве производственных культур используют специально подобранные штаммы, продуцирующие целевую кислоту в виде монопродукта с высокими выходами и эффективным усвоением углеродного субстрата. При многих производствах органических кислот экономический коэффициент по углероду достигает 90 % и выше. В качестве продуцентов используют бактериальные, дрожжевые и грибные культуры (Lactobacillus, Arthrobacter, Alcaligenes, Candida, Aspergillus, Penicillium, Trichoderma). Способы ферментации в микробиологических процессах производства органических кислот – разнообразны. Среди них – поверхностные жидко- и твердофазные процессы, а также глубинные, включая проточные культуры. В последние годы разработаны принципиально новые и эффективные биотехнологии с использованием иммобилизованных целых клеток и ферментов. Также разнообразны и субстраты, используемые в производстве органических кислот. Применяемые в начале века глюкоза и сахароза со временем стали заменять более доступными комплексными средами (мелассой, гидролизным крахмалом); в 60-е годы были разработаны новые процессы получения органических кислот на жидких парафинах нефти.
Пропионовокислые, или пропионовые бактерии были впервые выделены из сыров в 1878г. Фитцем и сыроделие – самая древняя биотехнология, использующая эти бактерии. Свое название они получили в связи с образованием при брожении больших количеств пропионовой кислоты. Характеризуются образованием в значительном количестве корриноидов (витамин В12) и каталазы, даже при росте в анаэробных условиях. Представлены бесспоровыми, неподвижными грамположительными палочками (0,5 × 0,7 – 2 мкм) и объединены в семейство Propionibakteriaceae. Содержание ГЦ в ДНК 65 – 68 мол. %. Подразделяют на «классические» и «кожные», последние ранее относили к коринебактериям. «Классические» пропионовокислые бактерии по современной классификации подразделены на четыре вида, вместо одиннадцати ранее описанных. Сокращение числа видов произведено главным образом на основании высокой степени гомологии ДНК представителей разных видов, хотя фенотипические свойства в их хорошо различимы, чем, видимо, объясняется частое употребление в литературе прежних названий.
Таблица 8 - Некоторые характеристики классических пропионовых бактерий (Propionibacterium)
| Современное название | Прежнее название | Г + Ц (мол. %) | Компоненты клеточных стенок | |
| P.freudenrechii | P.freudenrechii P. shermsni | 65-66 | Галактоза, манноза, рамноза | Мезо – ДАП |
| P. thöenii | P. thöenii P. rubrum | 66-67 | Комбинации из глюгозы, галактозы и маннозы | L - ДАП |
| P. jensenii | P. jensenii, P. zeae, P. technicum, P.petersonii, P. raffinosaceum | 66-67 | ||
| P.acidipropionici | P. arabinosum P. pentosaceum | 66-67 |
В последние годы в род Propionibakterium предложено включить кокки, имеющие с палочковидными бактериями много общих фенотипических свойств и высокую степень гомологию ДНК. Кокки выделяют из молока и сыров на ранних стадиях созревания. В отличие от типичных пропионовых бактерий, кокки растут на поверхности плотных сред. Классические пропионовые бактерии выделяют главным образом из сыров и молочных продуктов, кожные - живут обычно на поверхности кожных покровов человека и в желудке жвачных. Поэтому оптимум температуры, необходимо для роста, 37 0С, а для классических пропионовокислых бактерий 278 -32 0С. Кожные пропионовокислые бактерии обладают противолитической активностью. В отличие от классических видов они разжижают желатину и гидролизуют казеин. Кроме протеаз образуют и другие экстрацеллюлярные ферменты: гиалоуронат – лиазу, липазу, кислую фосфатазу. Кожные пропионовые бактерии представляют собой три вида: P. acnes, P. avidum и P. qranulosum. Изучают их главным образом в связи с этилогией и лечений кожных забеливаний, которые эти бактерии могут вызывать. Представители вида P. acnes входят в состав естественных микроорганизмов рубца жвачных. Они снабжают животных витамином В12, а также превращают углеводы в пропионовую и уксусную кислоты. Пропионат включает в синтез гликогена, а ацетат учувствует в синтезе жиров. Пропионовокислые бактерии обычно выделяют, используя среду следующего состава (%): триптиказа (BBL) – 1; дрожжевой экстракт (Difco) – 1,0; лактат натрия – 1; КН2РО4 – 0,25; MnSO4 – 0,0005; агар – агар (Difco) – 1,5; вода дистиллированная. Начальное значение рН - 6,8 – 7. лактат обусловливает некоторую элективность среды. Бактерии обусловливают некоторую элективность среды. Бактерии растут в анаэробных условиях; создают их путем внесения в среду восстановителей (например, 0,5 % сульфата натрия или 0,05 % цистеина + 0,05 % твина - 80), выращивание в толще среды или помещая чашки с инокулированной средой в анаэростаты, заполненные на 10 – 20 % углекислоты. Культуру рекомендуют поддерживать на среде, приготовленную из мяса, в закрытых пробирках в атмосфере углекислоты при комнатной температуре. Жизнеспособность клеток в таких условиях сохраняется в течении многих месяцев. Присутствие глюкозы в среде не способствует сохранению жизнеспособности культуры и вносить её в среды для хранения не рекомендуется. Классические пропионовые бактерии используют глюкозу, фруктозу, маннозу, галактозу и все (кроме P. freudenreichii) – лактозу. P. technicum и пропионовокислые кокки утилизируют крахмал. Отношение мальтозы и сахарозы – диагностический признак при дифференциации видов. Ассимилируют углекислоту.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1454; Нарушение авторских прав?; Мы поможем в написании вашей работы!