
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сублимационная сушка
|
|
|
|
Сублимационная сушка наиболее пригодна для живых микpооpганизмов, некоторых видов ферментов и других термолабильных продуктов. В этом случае меньше всего инактивируются ферменты, хорошо сохраняется жизнеспособность клеток. Сублимация - это переход твердого вещества при нагревании в газообразное состояние, минуя стадию жидкости. Сублимационная сушка продуктов микробиологического синтеза представляет собой частный случай вакуумной дистилляции льда методом испарения из замороженного продукта. Проведение сублимационной сушки под вакуумом (остаточное давление 0,1-10 кПа) дает возможность значительно повысить температуру процесса и тем самым сохранить клеточные структуры в жизнеспособном состоянии. Сублимационная сушка - это сложный технологический процесс, который состоит из нескольких последовательных этапов: подготовки материала, замораживания, сушки сублимацией, упаковки высушенного продукта. На каждом из этих этапов микроорганизмы могут потерять жизнеспособность, поэтому конечный результат зависит от строгого соблюдения технологии на всех этапах.
Подготовка биомассы. Сублимационной сушке подвергают концентрат суспензии микроорганизмов, полученный из культуральной жидкости одним из механических способов обезвоживания (фильтрованием, центрифугированием и т. п.). В концентрированную суспензию микроорганизмов добавляют в определенном количестве так называемую защитную среду, которая предохраняет клетки от гибели при замораживании и последующем высушивании. В качестве защитных сред используют коллоидные и гидрофильные вещества (белки, аминокислоты, углеводы и др.), которые замедляют внутриклеточное образование льда, уменьшают концентрирование электролитов и защищают клетки от глубокого необратимого обезвоживания. Подготовленная таким образом клеточная суспензия поступает на замораживание.
Замораживание
Замораживание - наиболее ответственный этап в технологии сублимационной сушки продуктов микробиологического синтеза. Замораживание биомассы приводит к физическим, биофизическим и биохимическим изменениям в клетке. В результате кристаллообразования при замораживании происходит повреждение и разрушение клеточных мембран и других структур клетки. Эти повреждения могут быть вызваны тремя основными причинами: 1) механическим воздействием на клетки кристаллов льда; 2) повышением концентрации электролитов, что вызывает денатурацию мембран; 3) снижением разности концентрации веществ внутри и снаружи клетки. Чтобы избежать денатурации белка в процессе замораживания, следует подбирать оптимальные условия кристаллизации воды. Большое значение имеет скорость замораживания. При медленном замораживании образуются крупные кристаллы льда, имеющие меньшую поверхность испарения, чем мелкие кристаллы, образующиеся при быстром замораживании. Для получения однородной массы кристаллов замораживание проводят быстро, поддерживая температуру воздуха в камере в интервале от 20 до 30°С и обеспечивая его интенсивную циркуляцию. Существует несколько способов замораживания биомассы: контактное замораживание на охлаждаемых полках, конвективное замораживание охлажденным газом, комбинированное замораживание (контакт и вентиляция), кондуктивное замораживание - погружение в охлажденную ванну. Выбор способа замораживания определяется свойствами микроорганизмов, подвергаемых сублимационной сушке. Сушка. Процесс сублимационной сушки проводят периодическим способом в сублимационных аппаратах - сублимационных камерах, или сублиматорах.
Сублимационные камеры представляют собой герметичные металлические горизонтальные аппараты чаше всего в форме цилиндра. Сублиматор соединен трубопроводом с конденсатом, в котором водяной пар из парогазовой смеси конденсируйся на трубчатой или плоской поверхности теплообменного устройства. Для создания вакуума и удаления из сублиматора парогазовой смеси применяют различные механические и эжекторные вакуум-насосы, которые устанавливаются после конденсатора.
| Рисунок 22 - Схема сублимационной установки периодического действия |
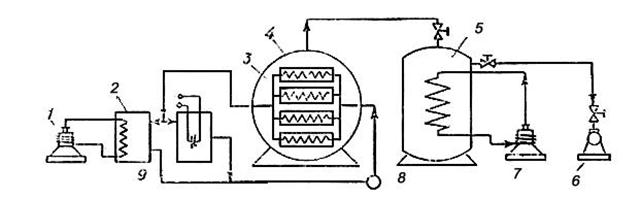
На рисунке представлена принципиальная схема сублимационной установки периодического действия. Высушиваемый продукт размешают на полках сублиматора. Внутри полок циркулирует с помощью насоса теплоноситель, который охлаждает полки при замораживании продукта или нагревает их в период сушки. Вакуум-насос создает необходимый вакуум и откачивает парогазовую смесь из сублиматора. Конденсация паров воды происходит в льдоконденсаторе, куда подается хладоагент от холодильной установки.
Процесс сушки методом сублимации льда в вакууме состоит из двух периодов. В первом, когда удаляется свободная вода, сушка притекает с постоянной скоростью, а во втором – скорость сушки. Первый период сушки проводят при достаточно низких температурах от 8 до 12°С, а во втором периоде температуру постепенно повышают до температуры окружающей среды. В некоторых случаях для удаления последних 2-3% воды продукт выдерживают при 60-70°С, что крайне отрицательно сказывается на его качестве. После сублимационной сушки продукт направляется на фасовку и упаковку, способы которых выбирают в зависимости от назначения и товарной формы биопрепарата. В последнее время все большее распространение получают сублимационные сушилки непрерывного действия. Процесс сублимационной сушки является весьма энергоемким и дорогим, но он незаменим в производстве ряда биопрепаратов, особенно для медицинских и ветеринарных целей.
Другие способы сушки
В микробиологической промышленности применяют несколько способов сушки суспензий микроорганизмов. Так, сушку хлебопекарных дрожжей проводят в конвективных сушилках, в которых подвод теплоты и удаление паров воды осуществляются с помощью газообразного сушильного агента - воздуха, топочных газов, инертных газов и т. д. Сушка дрожжей происходит во взвешенном состоянии при температуре не выше 35 °С.
Сушку молочнокислых бактерии (различных заквасок) осуществляют в распылительных сушилках при температуре в зоне распыления около 50°С (температура сушильного агента на входе в сушилку 130 - 150°С).
Применяется контактная сушка микроорганизмов, при которой их смешивают с наполнителями, активно поглощающими воду. Такой способ используется, например, при сушке спор плесневых грибов сухим активным углем, который смешивают со спорами в соотношении 5: 1. Контактным способом можно сушить дрожжи, смешивая их с крахмалом или мукой.
7. Эффективное проведение биотехнологических процессов тесно связано с совершенствованием способов контроля и управления. В период предыстории биотехнологии делались отдельные попытки регулировать развитие продуцента с помощью изменений параметров внешней среды. До середины ХХ века регулирование в основном сводилось к эмпирике, так как без знания сущности происходящего невозможно эффективно контролировать и управлять процессом. В основном, объектом управления того периода была экстенсивная периодическая культура микроорганизмов со всеми ее недостатками: динамикой состояния продуцента и среды, отсутствием средств контроля. В последние 25 лет с внедрением управляемых культур биотехнологи переходят от простой задачи поддержания определенных параметров среды к управлению процессом в целом. Для реализации управляемого культивирования необходимо построение алгоритмов управления, основанных на моделях биотехнологического процесса. В современных биотехнологических процессах необходимо регистрировать и анализировать множество быстроизменяющихся факторов (концентрацию субстрата, биомассы и продукта в культуре, рН, температуру, парциальное давление кислорода и др.) (табл. 1.3). Это вызывает необходимость в применении электронной техники. Первые разработки по применению ЭВМ в биотехнологии относятся к концу 60-х гг. ХХ века. На первых этапах ЭВМ привлекали в качестве советчика оператора, управляющего исполнительными механизмами для поддержания оптимального течения биотехнологического процесса. Прежде всего, для сбора и обработки информации по показаниям датчиков и для представления этой информации в легковоспринимаемой форме. Разрабатывали также системы автоматического регулирования отдельных параметров (дозировка среды или отдельных компонентов, стабилизация температуры и рН среды, скорости протока) по принципу контроля с обратной связью. Позднее ЭВМ стали использовать для управления технологическим процессом в целом в составе автоматизированных систем АСУ. Задача создания АСУ стала особенно актуальной при реализации крупнотоннажных биотехнологических процессов. В настоящее время АСУ осуществляется на основе системного подхода, и управление имеет многоуровневую иерархическую систему. Внедрение АСУ позволяет осуществить рациональное управление процессом биосинтеза. В результате этого экономятся исходное сырье, электроэнергия, вода, повышается продуктивность процесса и производительность труда обслуживающего персонала. Затраты на создание и внедрение АСУ в биотехнологии окупаются сравнительно быстро, в течение 3–4 лет. Обычная схема контроля и управления ферментацией включает ферментер, датчики, регулирующую систему, которая реализует расчетные зависимости на основе измерения параметров процесса. Исходные данные от датчиков поступают на ЭВМ, в которой они оперативно анализируются, и в результате выдаются данные для исполнительных устройств и механизмов. В настоящее время разработка и внедрение АСУ для биотехнологических процессов, прежде всего, определяется уровнем технической оснащенности данных процессов и зависит от уровня электронного оборудования, средств контроля и автоматизации. Возникают также проблемы вследствие большой информационной емкости биотехнологических процессов. Эффективность АСУ зависит от быстродействия и объема памяти ЭВМ. Поэтому прогресс в области биотехнологии зависит от прогресса в области электроники. Большое будущее имеет, в частности, микропроцессорная техника. Внедрение АСУ сдерживается отставанием в создании надежной и быстродействующей контрольно-
Таблица 9 - Величины и расчетные параметры, применяемые для управления биотехнологическими процессами
|
измерительной аппаратуры, выдерживающей стерилизацию и удовлетворяющей современные требования к чувствительности и точности измерения, быстродействию, надежности, миниатюризации.
8. Моделирование является одним из наиболее значимых направлений при разработке биотехнологических процессов, так как с помощью моделирования, экспериментального и математического, исследуются и разрабатываются новые процессы, совершенствуются аппараты и технологические схемы производств. При экспериментальном моделировании в лабораторных и промышленных условиях применяются, как правило, модели объектов и процессов, отличающиеся масштабами. Экспериментальное моделирование позволяет исследовать и оптимизировать процессы, сущность которых мало изучена. Данный подход часто служит единственным средством для исследования биотехнологического процесса. Первым этапом экспериментального моделирования служит лабораторный уровень, в ходе которого при сравнительно небольших затратах проводится изучение новых продуцентов и разработка новых процессов. Далее полученные результаты переносят в опытные, полупромышленные и промышленные масштабы. На опытных установках отрабатываются все технологические детали будущего процесса, обучается персонал, создается оборудование, уточняются технико-экономические показатели. Затем проводятся крупномасштабные дорогостоящие промышленные эксперименты и испытания. Экспериментальное моделирование имеет ряд особенностей: трудоемкость, сложность реализации новой модели процесса. Наиболее трудны при этом вопросы масштабирования технологии и оборудования. Развитие биологических агентов связано не только с поведением жидкости и реагентов в ферментере, но и с их собственным метаболизмом. Поэтому масштабирование в биологии требует специальных решений, при этом до настоящего времени нет единого подхода к решению данной задачи. Для оптимизации и управления биотехнологическими процессами, помимо экспериментального, необходимо также привлечение математического моделирования. Эти два подхода, дополняя друг друга, позволяют более эффективно решать поставленные задачи. Экспериментальное моделирование часто предшествует математическому, являясь для него источником информации. Математические модели – удобное средство обобщения экспериментальных данных. Наличие математических моделей позволяет более обоснованно подходить к планированию экспериментов и обрабатывать данные, существенно сокращать объем экспериментальных работ. Для моделирования и расчета биотехнологических процессов в силу их сложности применяют системный подход. Математическая модель сложной биосистемы должна включать описание различных по своей природе объектов и явлений. Поэтому, анализируя биологическую системы в целом, применяют метод декомпозиции, расчленяя исходную систему на ряд подсистем: строятся модели массообмена, кинетики роста биообъекта и биохимических процессов. К настоящему времени разработано много моделей массообмена, кинетики потребления субстрата и образования различных продуктов. Наиболее сложная задача – моделирование собственно биологических объектов, так как они значительно сложнее химических, физических и технических. Объекты биотехнологии способны к саморегулированию, их сложность усугубляется неоднородностью. Процессы, протекающие в биореакторе, зависят не только от сложных внутриклеточных факторов, но и от условий внешней среды; в свою очередь, внешние процессы в биологии связаны с внутренними, поэтому их разделить нельзя. Кроме этого, на данном этапе уровня развития математической биологии отсутствует теория, адекватная сущности биологических процессов. Пока не создан математический аппарат, способный описать природу биологических превращений во всем многообразии, то есть необходимо развитие и совершенствование самого математического аппарата. Математическое описание биологических объектов дополнительно осложняется их недостаточной изученностью. Поэтому на данном этапе возможно достаточно упрощенное и приближенное математическое описание биологических объектов, это направление нуждается в существенном совершенствовании. Оптимизация биотехнологических процессов осуществляется на основе сочетания экспериментального и математического моделирования и применения современных методов оптимизации (динамического и нелинейного программирования, вариационного исчисления). Однако в настоящее время для оценки оптимальности биотехнологических процессов трудно даже подобрать критерии. При оптимизации в биотехнологии необходимо учитывать ограничения, связанные с экономическими и конструктивными условиями, возможностями контрольно-измерительной аппаратуры и средств управления, экологическими требованиями и др. Моделирование и оптимизация биотехнологических процессов – задача сложная и во многом еще не решенная. Однако именно разработка адекватных моделей различных биотехнологических процессов и на их основе создание совершенных методов оптимизации и управления – важнейшее направление биотехнологии, без которого невозможен прогресс
9,10. Методы высокой очистки – тонкослойная хроматография, электрофорез и т.д. Приготовление готовых форм – таблетирование, ампулирование, фасовка и т.п.- для самостоятельной работы студента.
11. В определении оптимального направления развития биологических технологий, независимо от области их применения, большую роль играет международное сотрудничество, которое обеспечивает выбор той или иной технологий с учетом экономико-социальных условий отдельных стран. Примером региональной кооперации в биотехнологии может служить Центрально-Американский институт промышленных исследований (ICAITI), созданный в 1955 г. Этот институт, расположенный в Гватемале, содействует промышленному развитию региона, который может обеспечить достаточный уровень биопромышленности с учетом имеющихся территорий, климато-географических условий и огромного количества имеющихся здесь побочных продуктов и отходов сельскохозяйственного производства. В рамках ICAITI в 1970 г. был создан биотехнологический отдел, являющийся штаб-квартирой Международного центра по исследованию микробных ресурсов (MIRCEN) данного региона, субсидируемого ЮНЕСКО. Исследовательские проекты института сосредоточились в двух направлениях, связанных с основными видами сельского хозяйства региона: переработкой кофейных зерен и получением сахара. Накапливающиеся в огромных количествах отходы данных технологий были использованы в качестве субстратов для производства биогаза и микробной биомассы. Были разработаны также процессы получения спирта из соков тропических фруктов, а на основе иммобилизованных ферментов созданы производства осахаривания фруктозных сиропов из сахарного тростника, разработаны новые технологии ферментации овощей под воздействием чистых культур лактобацилл. Таким образом, наличие этого института сформировало фронт биотехнологических работ, внедрение которых способствовало экономическому развитию региона.
С целью переноса новейших технологий из развитых стран в развивающиеся ООН создан Международный центр генной инженерии и биотехнологии. Под эгидой Организации промышленного развития ООН (UNIDO) создана комиссия для изучения мнения государств-членов по взаимодействию с Международным центром. На базе совместных исследований центром запланировано создать школу для подготовки специалистов из развивающихся стран. В качестве направлений совместных исследований комиссией UNIDO рекомендованы: использование энергии биомассы, добыча нефти из истощающихся скважин, усовершенствование методов ферментации, синтез лекарств против тропических болезней, получение эффективных вакцин для человека и домашних животных, селекция высокоурожайных и устойчивых к болезням сортов культурных растений.
На протяжении ряда лет программы крупнейших международных организаций (ФАО, ВОЗ, ЮНЕСКО) содействуют развитию и расширению международного сотрудничества в прикладной микробиологии и технологии. В начале 70-х гг. ЮНЕСКО субсидировало создание Международной организации исследования клетки (ICRO). В начале 80-х гг. в рамках «Программы окружающей среды» (UNEP) ЮНЕСКО основало международную программу, призванную охранять генетическое разнообразие микробных ресурсов и сделать их доступными для развивающихся стран. С середины 80-х гг. начала формироваться сеть международных центров по исследованию микробных ресурсов (MIRCEN). Цели данного формирования следующие: интеграция и сотрудничество между лабораториями; распределение и использование микробных ресурсов; сохранение микробного генофонда; разработка новых видов недорогих и эффективных технологий; использование микробиологии в практике сельского хозяйства; обучение персонала и распространение новой информации, связанной с общей и прикладной микробиологией.
Первым шагом в создании сети MIRCEN было образование в Австралии Международного центра данных о микроорганизмах. Центр обладает огромной коллекцией микробных штаммов и имеет мировой указатель микробных коллекций. Аналогичные центры созданы в Бангкоке – для стран Юго-Восточной Азии, в Найроби – для Африки, в Бразилии – для Южной Америки, в Гватемале – для Центральной Америки, в Каире – для арабских стран. Специализация направлений исследований в этих центрах связана с климато-географическими особенностями и экономикой регионов и способствует их развитию.
Развитие всех современных направление биотехнологии, включая экологическую биотехнологию, происходит в настоящее время настолько быстро, что точные прогнозные оценки в этой области весьма затруднительны. Биологические технологии целиком базируются на научных достижениях. При этом то, что лишь недавно было предметом лабораторных исследований, сегодня активно внедряется в производство. Круг наук, результаты которых воплощаются в биотехнологию, непрерывно расширяется. Таким образом, расширяются возможности и сферы самой биотехнологии. Вероятно, в будущем не будет ни одного направления человеческой деятельности, которое не было бы в тех или иных пределах связано с биотехнологией.
Постановка новых биотехнологических процессов связана с большими капиталовложениями и высоким риском. Внедрение новейших методов биотехнологии особенно перспективно, когда целевой продукт не может быть получен иными способами или масштабы его производства малы, а цены очень высоки. Особенно это касается фармакологических препаратов и диагностических средств. В этой связи огромные перспективы у иммунной биотехнологии, с помощью которой можно распознавать и выделять из смесей одиночные клетки. Эти возможности очень важны и перспективны для диагностики и лечения, в фармакологической, пищевой промышленности, для очистки гормонов, витаминов, белков, токсинов, вакцин и пр., а также в научных исследованиях.
Дальнейшее развитие биологических технологий во многом связано с прогрессом в области технических наук. Повышение эффективности биотехнологических процессов невозможно без автоматизации и совершенствования аппаратурного и технологического оформления процессов. Это позволит повысить эффективность традиционных биотехнологических процессов и расширит сферы применения получаемых продуктов. Сегодня огромные средства инвестируются на масштабирование биотехнологических процессов. По оценкам специалистов, инвестиции в этой области будут возрастать в среднем на 9 % в год, и к 2000 г. составят свыше 14 млрд. долл. в год.
Новые перспективы для биотехнологических производств связаны с разработкой биодатчиков. В настоящее время применяются и создаются в основном ферментные и микробные электроды, иммунодатчики и электродные резисторы. Пример будущего применения биодатчиков – различные области, в том числе определение биологически активных органических веществ в крови, а также концентраций токсических веществ в различных средах, включая вирусы и патогены, нервно-паралитические газы; контроль количества пестицидов и других ксенобиотиков в среде; диагностика заболеваний человека, животных и растений; качественный анализ пищевых продуктов и пр. По разным оценкам рынок биодатчиков составит к 2010 г. от 0.5 до 14 млрд. долл.
Большое будущее у протоинженерии – технологии изменения свойств природных белков на генетическом уровне и получения новых белков (стимуляторов роста растений, инсектицидов, высокоактивных и устойчивых ферментов, биосенсоров и биоэлементов для ЭВМ).
Важнейшая роль принадлежит биотехнологии в решении проблемы обеспечения населения планеты пищевыми продуктами. В этой области грядущие усовершенствования связаны с получением высокопродуктивных и устойчивых к болезням и вредителям культурных растений и сельскохозяйственных животных, внедрением генов азотфиксации в высшие растения, получением эффективных биопестицидов и биогербицидов. Согласно прогнозам, мировой рынок традиционных продуктов биотехнологии составит к 2010 г. более 50 млрд. долл. При этом мировой объем продаж составит (в млрд. долл. в год): продуктов для пищевой промышленности и сельского хозяйства – 21.20; медицинских препаратов – 10.08; других продуктов – 18.40.
Велики перспективы биотехнологии в создании новых источников энергии. Экологически чистые биотехнологические способы получения энергии уже в настоящее время оказывают существенное влияние на энергетический потенциал общества. Продолжение исследований по усовершенствованию процессов метаногенеза, получения спиртов, а также преобразования различных видов энергии и созданию биотопливных элементов, чрезвычайно перспективны и обещают большие экономо-экологические выгоды. Прогнозируется, что объем продажи биотехнологических энергоносителей к 2010 г. составит около 16.35 млрд. долл. в год.Более широкое применение биотехнологии в добывающей промышленности приведет к переходу от тяжелой индустрии к высоким технологиям. Применение методов биогеометаллургии позволит вовлечь в производство огромное количество отходов, забалансовые, а также трудноперерабатываемые руды и горные породы.
Генетическую инженерию следует рассматривать как одно из приоритетных направлений развития биотехнологии. Рынок генноинженерных продуктов к 2000 г. предположительно составит около 40 млрд. долл. и будет включать до 40 наименований. Основными среди них будут интерфероны, человеческие гормоны, моноклональные антитела, противораковые агенты, вакцины, тромболитики.
Прогнозируя мировой объем продажи продуктов биотехнологии, многие специалисты ведущих западных фирм полагают, что ежегодный прирост составит около 7.5 % и к 2000 г. достигнет 60–65 млрд. долл.. Около 80 % этой суммы придется на традиционные продукты и 20 % – на новые.
На основе ферментов намечено получать до 32 % общего объема вырабатываемых препаратов; 40–50 % продукции составят аминокислоты, медицинские препараты, включая полученные на основе рекомбинантных ДНК.
Таблица 10 - Прогноз мирового рынка продуктов, получаемых методами новейшей биотехнологии, в млрд. долл.
|
Таблица 11 - Прогнозируемый рынок биодатчиков в 1990–2010 гг.
Таблица 12 - Прогноз мирового рынка традиционных продуктов биотехнологии в 2010г.
|
Расширение сферы внедрения биотехнологии изменяет соотношение в системе «человек – производство – природа», повышает производительность труда, принципиально изменят его качество. Биологизация производства в целом – одно из важнейших направлений в создании гибких саморегулирующихся производственных процессов будущего, которые гармонично вписываются в природу, не причиняя ей вреда. В настоящее время последствия антропогенной деятельности достигли такой грани, когда дальнейшая некоординируемая деятельность может привести к необратимым изменениям в биосфере в целом. Это может привести к тому, что биосфера станет непригодной для обитания человека. Разрешение этого противоречия, то есть создание такого равновесия в природе, которое в состоянии привести к гармоничному сосуществованию возрастающего населения планеты и биосферы, возможно только на основе дальнейшего развития науки и техники. Для этого необходимо разумное развитие человеческого общества в целом, направленное не на разрушение биосферы, а на ее дальнейшее развитие. Последнее, в свою очередь, должно оказывать позитивное влияние на дальнейший прогресс человечества, то есть создание ноосферы. Один из основных путей решения данной проблемы – дальнейшее развитие биологии и расширение сферы применения биотехнологии. Внедрение биотехнологии ведет к созданию экологически чистых технологий в различных сферах человеческой деятельности, включая более рациональное использование природных ресурсов и создание замкнутых производственных циклов.
Вопросы для самопроверки
1. Определение оптимального направления развития биологических технологий
2. Прогноз мирового рынка продуктов, получаемых методами новейшей биотехнологии
3. Расширение сферы внедрения биотехнологии
4. Рынок генноинженерных продуктов
5. Прогнозируемый рынок биодатчиков
6. Постановка новых биотехнологических процессов
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 5582; Нарушение авторских прав?; Мы поможем в написании вашей работы!