
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взаимно нерастворимых компонентов бинарной смеси бензола и воды
|
|
|
|
Так как согласно закону Дальтона давление паровой или газовой смеси равно сумме парциальных давлений ее компонентов, то кривая С показывает зависимость между давлением и температурой кипящей смеси бензол-вода. Пересечение кривой С с горизонталью, соответствующей 760 мм рт.ст., показывает, что при давлении 760 мм рт.ст. смесь кипит при температуре около 70оС, а также что парциальное давление паров воды в паровой смеси равно 225, а паров бензола – 535 мм рт.ст. независимо от содержания воды и бензола в жидкой смеси. Таким образом, смесь из двух взаимно нерастворимых жидкостей закипает при температуре более низкой, чем температура кипения легкокипящей жидкости, входящей в смесь. Пользуясь этим свойством, в технике применяют дистилляцию некоторых жидкостей с водяным паром. Как и перегонка под вакуумом, такой способ особенно пригоден для дистилляции жидкостей, точка кипения которых при атмосферном давлении настолько высока, что они при температуре кипения разлагаются.
При дистилляции с водяным паром двух- или многокомпонентная жидкость, подлежащая разгонке, смешивается с водой, смесь кипятится, а образующиеся пары конденсируются. После конденсации получается жидкая смесь одного из компонентов и воды, которая в большинстве случаев разделяется простым расслоением конденсата из-за разных удельных весов компонентов или механическими методами (отстаиванием, центрифугированием). Часто дистилляция с водяным паром применяется для отделения высококипящих веществ от нелетучих растворенных примесей.
В табл.1 приведены данные о понижении температуры кипения ряда веществ при перегонке с водяным паром при атмосферном давлении, а также содержание перегоняемого вещества в парах.
Таблица 1.
| Название вещества | Температура кипения, оС | Содержание отгоняемого вещества в паре, % | |
| чистого вещества | вещества с водяным паром | ||
| Анилин | 189,9 | 98,4 | 23,1 |
| Бензол | 80,4 | 69,2 | 91,1 |
| Нафталин | 128,0 | 99,3 | 14,4 |
| Нитробензол | 208,3 | 99,3 | 25,0 |
| Ртуть | 356,8 | 100,0 | 0,4 |
Температура кипения смеси со взаимно нерастворимыми компонентами постоянна и не зависит от содержания компонентов в жидкой смеси. И только в тот момент, когда один компонент выкипит полностью, она делает скачок и становится равной температуре кипения оставшегося компонента. Содержание компонентов в паровой фазе остается постоянным и тоже не зависит от соотношения их в жидкой фазе до того момента, пока один компонент не выкипит полностью.
На рис.2-18,б изображен график для бинарной смеси со взаимно нерастворимыми компонентами. Зависимость содержания легкокипящего компонента (бензола) в парах от содержания его в жидкости изображается прямой bc. Пересечение этой прямой в точке «а» с диагональю 0d соответствует равновесному состоянию, когда содержание по весу легкокипящего компонента (бензола) в парах и жидкой фазе одинаково. Точка «а» называется азеотропической точкой, а жидкая смесь, соответствующая этому состоянию, ¾ азеотропической смесью. Температура кипения азеотропической смеси остается постоянной до полного выкипания смеси.
Азеотропические смеси характеризуются тем, что ни один компонент их не может быть выделен перегонкой в чистом виде, так как состав паров и жидкой смеси совершенно одинаков. Если летучего компонента в первоначальной жидкой смеси больше, чем в азеотропической смеси (точка А на рис.4-1,б), то после некоторой перегонки, во время которой из жидкости удаляются пары с составом азеотропической смеси (точка А смещается вправо), остается жидкий остаток из чистого летучего компонента (бензола в данном случае). Наоборот, если летучего компонента в первоначальной жидкой смеси меньше, чем азеотропической смеси (точка В на рис.4-1,б), то при перегонке точка В смещается влево и в жидкости остается нелетучий компонент (вода).
Бинарные смеси (растворы) со взаимно растворимыми компонентами. Растворы из полностью растворимых друг в друге жидкостей делятся на подчиняющиеся закону Рауля (идеальные) и имеющие положительное или отрицательное отклонение от закона Рауля (растворы с минимальной и максимальной температурами кипения).
Закон Рауля гласит, что парциальное давление пара каждого компонента в паровой смеси над кипящей при какой-либо температуре жидкой смесью равно давлению насыщенного пара этого компонента, кипящего в чистом виде при той же температуре, умноженному на молекулярную долю этого компонента в жидкой смеси.
Под молекулярной долей компонента подразумевается отношение числа молей его в смеси к суммарному числу молей обоих компонентов. Если в бинарной смеси вещество с молекулярным весом mа находится в количестве а% по весу, а вещество с молекулярным весом mв в количестве b%, то молекулярные доли компонентов смеси определяются по формулам:
 ;
; 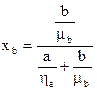 ,
,
причем ха + хb = 1.
Молекулярные доли можно выражать также в процентах. Число моль-процентов компонента получается умножением вышеприведенных формул на 100.
Математически закон Рауля можно выразить в следующем виде:
ра = Ра×х,
где ра – парциальное давление пара компонента «а» над кипящей смесью;
х – молекулярная доля этого компонента в жидкой смеси;
Ра –давление насыщенного пара компонента «а» при температуре кипения
смеси.
Аналогичное уравнение для компонента b:
pb = Pb (1-x).
Если Р обозначает суммарное давление, то
Р = ра + рb = Pa x + Pb (1-x).
На рис.2-19,а представлен графически закон Рауля для бинарной смеси. По оси ординат отложены упругости паров, а по оси абсцисс – состав смеси в моль-процентах. Начало координат соответствует содержанию в смеси 100 моль-процентов вещества В (нелетучего компонента) и, следовательно, нулю моль-процентов вещества А. Конечная точка оси абсцисс соответствует 100 моль-процентам летучего компонента А.
На основании приведенных формул следует, что парциальные давления паров обоих компонентов изображаются прямыми линиями. Суммарное давление тоже изображается прямой, проведенной через конечные точки прямых А и В.
Таким образом, при слиянии двух жидкостей, химически не действующих друг на друга и дающих однородный раствор, суммарное давление паров при изменении состава раствора изменяется монотонно по прямолинейному закону в зависимости от величины упругости пара одной жидкости, кипящей в чистом виде при той же температуре, до величины упругости пара второй жидкости в тех же условиях.
Графическое изображение связи между температурой кипения жидкой смеси, составом жидкости и составом получающихся паров при заданном давлении, называемое диаграммой кипения и конденсации, или фазовой диаграммой, приведено на рис.2-19,б.
По оси ординат графика отложена температура смеси, а по оси абсцисс – молекулярные доли компонентов в жидкой и паровой фазах. Зависимость между температурой кипения жидкой смеси и ее составом изображается нижней линией, называемой кривой кипения. Состав получающихся паров в зависимости от температуры кипения изображается верхней пунктирной кривой. Так как в результате полной конденсации паров получается жидкая смесь того же состава, что и паровая, то эту кривую называют линией сухого пара или кривой конденсации. Из диаграммы ясно, что содержание легкокипящего компонента в парах больше, чем в жидкости (y > x). Точки Е и С соответствуют температурам кипения чистых компонентов при заданном давлении.

Рис.2-19. Характерные зависимости для бинарных смесей,
подчиняющихся закону Рауля.
а– упругость паров над кипящей жидкостью в зависимости от состава;
б – диаграмма кипения и конденсации смеси (фазовая t-x-диаграмма);
в – диаграмма равновесия y = x.
Кривая равновесия для бинарной смеси (рис.2-19,в) иллюстрирует зависимость состава пара от состава жидкой смеси. Состав смеси обычно характеризуется содержанием в ней летучего компонента, поэтому по оси абсцисс откладывается содержание летучего компонента в жидкости х, а по оси ординат – в парах y. Величины х и y обычно выражаются в моль-процентах или в весовых процентах.
Для более летучего компонента «y» всегда больше «х», поэтому кривая равновесия смеси взаимно растворимых жидкостей располагается над диагональю квадрата, построенного на сторонах х =100 моль-процентам и y =100 моль-процентам. Отсюда следует, что для растворов, подчиняющихся закону Рауля, азеотропической точки не существует.
Жидкости, частично растворимые одна в другой. Для частично взаимо растворимых жидкостей содержание летучего компонента в парах вычисляется в две стадии. В пределах растворимости компонентов расчет ведут по закону Рауля или по экспериментальным таблицам, а во второй фазе (в пределах нерастворимости) – по закону Дальтона.
Примером частично растворимых жидкостей являются фенол и вода. При 20оС вода растворяет до 8,4% по весу фенола, а при 50оС растворимость его увеличивается до 12,08%. Фенол растворяет воду при 20оС в количестве до 27,76%, а при 50оС до 37,17% (проценты даны по отношению ко всей смеси).
Если по оси абсцисс отложить концентрацию воды и фенола, а по оси ординат – температуры, как это представлено на рис.2-20,б, то окажется, что кривые растворимости одного компонента в другом в действительности представляют собой одну кривую, проходящую через максимум в точке, соответствующей составу смеси с 39,9% фенола и 64,1% воды при температуре смеси 68,8оС.
На рис.2-20,а для иллюстрации дан график зависимости между составом жидкой частично растворимой смеси и давлением паровой смеси при постоянной температуре.
 а) б)
а) б)
Рис.2-20. График зависимости растворимости и парциальных давлений
от состава частично растворимой бинарной смеси фенол-вода.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2364; Нарушение авторских прав?; Мы поможем в написании вашей работы!