
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальні гази
|
|
|
|
Реальнi гази — гази, властивостi яких залежать вiд взаємодiї молекул. Сили мiжмолекулярної взаємодiї проявляються на вiдстанi 10-9 м i швидко зменшуються при збiльшеннi вiдстанi мiж молекулами. Такi сили - короткосяжнi.
Виводячи рiвняння стану iдеального газу, нехтують розмiрами молекул i їх взаємодiєю одна з одною. Пiдвищення тиску приводить до зменшення середньої вiдстанi мiж молекулами, тому потрiбно враховувати об’єм молекул i взаємодiю мiж ними.
Мiж молекулами одночасно дiють сили притягання i сили вiдштовху-вання. На вiдстанi г = г0 результуюча сила F = 0. Вiдстань г0 вiдповiдає рiвноважнiй вiдстанi мiж молекулами, на якiй би вони знаходились за вiдсутностi теплового руху. Якщо r<r0, то переважають сили вiдштовхування (F>О), якщо г>г0,— сили притягання (F<0) (рис.2.17).

Рис.2.17
Наявність сил відштовхування зводиться до того, що фактично вільний об’єм, в якому можуть рухатись молекули реального газу, буде не Vm, а Vm -b, де b – об’єм, що “заборонений ”для руху молекул.

Рис.2.18
Двi молекули можуть наблизитися на вiдстань не меншу, нiж сума їх радiусiв (d=r+r) (рис.2.18).Тому b пропорцiйна об’єму сфери, яка описана радiусом d, i кiлькостi молекул, якi спiвударяються:
b=4NAVo, (2.62)
де N A - число Авогадро, V0 - об’єм однієї молекули.
Дія сил притягання між молекулами реального газу приводить до появи додаткового тиску, що називається внутрішнім тиском.
Рiвняння стану реальних газiв можна отримати, якщо в рiвняння Менделєєва - Клапейрона ввести поправки, якi зв’язанi з врахуванням влас-ного об’єму b молекул i сил притягання  молекул.Тодi рiвняння стану набере вигляду:
молекул.Тодi рiвняння стану набере вигляду:
(P+  )(Vm-b)=RT,
)(Vm-b)=RT,
де 
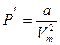 .
.
Це рiвняння має назву рiвняння Ван-дер-Ваальса:
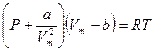 . (2.63)
. (2.63)
Для довiльної маси m газу
 , (2.64)
, (2.64)
де а і b – постійні Ван-дер-Ваальса, що визначаються дослідно для кожного газу.
Iзотерми газу, якi описуються рiвнянням Ван-дер-Ваальса, мають вигляд, наведений на рис.2.19, де Т1 <Т2 <Тк <Т3.

Рис.2.19
Розглянемо iзотерми при Т < Tk (рис.2.20). •На дiлянках 1—3 i 5 —7 при зменшеннi об’єму V зростає тиск, що відповідає експерименту. Частина ізотерми 1-2 відповідає газоподібному стану, а частина 6-7 - рідині.Стан 2-3 називається перенасиченою парою. Це нестійкий стан: достатньо в стані А попадання пилинки в пару, щоб вся речовина розпалась на дві фази і перейшла в стан В на прямій 2-4-6.Частина ізотерми 6-5 відповідає стану рідини. Цей стан речовини називається перегрітою рідиною. Якщо в перегріту рідину кинути пісчинку, то відбувається швидкий перехід із рідкого стану в газоподібний, який супроводжується бурхливим кипінням рідини. Тиск газу зростає до тиску, що відповідає ділянці 2-4-6 (перехід С Д на (рис.2.20)).Стан 2-3 і 6-5 називається метастабільним. На ділянці 3-5
Д на (рис.2.20)).Стан 2-3 і 6-5 називається метастабільним. На ділянці 3-5  стискання речовини приводить до зменшення тиску.У природі немає таких речовин. Істинна ізотерма має вигляд ломаної лінії 1– 2 – 6 – 7. При підвищенні температури горизонтальна ділянка сімейства ізотерм зменшується. Ізотерма, що не має таких ділянок називається критичною, а температура Тк - критичною (рис.2.19). Відповідні Тк об’єм Vк і тиск Рк називаються критичними. Критичні параметри Тк,Vк, Рк виражаються через Ван –дер –Ваальсівські поправки а і b.
стискання речовини приводить до зменшення тиску.У природі немає таких речовин. Істинна ізотерма має вигляд ломаної лінії 1– 2 – 6 – 7. При підвищенні температури горизонтальна ділянка сімейства ізотерм зменшується. Ізотерма, що не має таких ділянок називається критичною, а температура Тк - критичною (рис.2.19). Відповідні Тк об’єм Vк і тиск Рк називаються критичними. Критичні параметри Тк,Vк, Рк виражаються через Ван –дер –Ваальсівські поправки а і b.
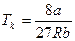 ,
,  , Vk=3b. (2.65)
, Vk=3b. (2.65)

Рис.2.20
Якщо через крайні точки горизонтальних ділянок Ван – дер – Вааль-сівських ізотерм провести лінії, то одержуємо область двофазних станів речовини (рис.2.21). Газ, який знаходиться в стані при температурі, що вища за критичну, не може бути перетворений в рідину ні при якому тиску.
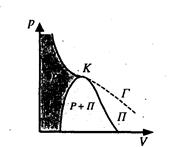
Рис.2.21
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1446; Нарушение авторских прав?; Мы поможем в написании вашей работы!