
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомные спектры
|
|
|
|
Общие сведения. Строение внешних электронных оболочек атомов определяет особенности атомных оптических спектров элементов, отсюда внешние валентные электроны называют также и оптическими электронами. Атомы со сходными внешними электронными оболочками имеют не только сходные химические свойства, но и близкие по строению оптические спектры. Оптические характеристические спектры элементов можно наблюдать только в том случае, когда их атомы изолированы, т.е. когда исследуемое вещество “атомизировано” и имеет при этом малую плотность.
В изолированном атоме распределение электронов на энергетических уровнях соответствует минимуму его внутренней энергии, и он находится в основном, или нормальном, состоянии (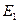 ). При определенных условиях атом может быть переведен в возбужденное состояние или же в состояние ионизации.
). При определенных условиях атом может быть переведен в возбужденное состояние или же в состояние ионизации.
Возбужденные состояния, как и состояния ионизации, характеризуются дополнительной энергей, которая может принимать лишь определенные значения. Поэтому внутренняя энергия при возбуждении и ионизации изменяется скачками. Каждому элементу присущи свои характерные энергетические состояния возбуждения и ионизации, которые зависят от заряда атомного ядра и от строения электронных оболочек.
Энергия, необходимая для перевода атома из основного состояния, в какое – либо возбужденное состояние, называется энергией возбуждения, а энергия, необходимая для ионизации, - энергией ионизации.
 Энергетические состояния атома – уровни энергии изображают параллельными отрезками, расстояние между которыми пропорционально разности их энергий (рис.1.1). Разрешенные изменения энергетических состояний атома (иона), так называемые дозволенные энергетические переходы, изображают на диаграммах стрелками или же отрезками прямых, соединяющими начальный и конечный уровни. Число уровней очень велико и они становятся чаще по мере удаления от основного стационарного уровня и приближения к границе, соответствующей энергии ионизации.
Энергетические состояния атома – уровни энергии изображают параллельными отрезками, расстояние между которыми пропорционально разности их энергий (рис.1.1). Разрешенные изменения энергетических состояний атома (иона), так называемые дозволенные энергетические переходы, изображают на диаграммах стрелками или же отрезками прямых, соединяющими начальный и конечный уровни. Число уровней очень велико и они становятся чаще по мере удаления от основного стационарного уровня и приближения к границе, соответствующей энергии ионизации.
Число допустимых энергетических состояний атома изменяется периодически по мере увеличения номера элемента. Наиболее просты схемы энергетических состояний элементов первой группы, имеющих по одному внешнему электрону при заполненных предыдущих оболочках. Наиболее сложные системы у “переходных” элементов, лантаноидов и других с достраивающимися нижними d – и f –подуровнями и с несколькими оптическими электронами на последнем уровне.
Таким образом, в пределах каждого периода таблицы Менделеева схема энергетических состояний атомов усложняется по мере увеличения атомного номера.
При этом увеличивается как разность энергий соседних возбужденных уровней, так и энергия самого нижнего возбужденного уровня. Самый низкий возбужденный уровень принято называть резонансным.
Элементы, атомы которых имеют заполненные внешние электронные оболочки, и элементы, заканчивающие периоды таблицы Менделеева, имеют наибольшие энергии ионизации и возбуждения резонансных уровней, а элементы, с которых начинаются периоды, т.е. имеющие по одному внешнему оптическому электрону, имеют наименьшие энергии ионизации и энергии возбуждения резонансного уровня. По мере увеличения номера указанных элементов увеличиваются энергии ионизации и энергии резонансного уровня. Возбужденное состояние атома неустойчиво; через более или менее непродолжительное время (»10-6-10-8 с) атом возвращается в исходное состояние с Е=Е1 сразу или же путем ряда последовательных переходов на промежуточные уровни. Соответственно он теряет всю избыточную энергию сразу или по частям. Переходы могут происходить самопроизвольно (спонтанно) или вынужденно под действием других частиц и излучения.
Способы возбуждения и ионизации атомов. Возбуждение и ионизация достигаются бомбардировкой атомов исследуемого вещества быстрыми электронами, а также при взаимодействии атомов с излучением.
Соударение с электроном может с той или иной вероятностью привести к ионизации атома, при условии, что кинетическая энергия электрона Еk равна или больше энергии ионизации данного элемента Еu.
Для возбуждения атома в основном стационарном состоянии Е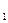 до некоторого состояния Е2, или для его перехода из одного возбужденного состояния Е2 в более высокое возбужденное состояние Е3 кинетическая энергия электрона должна быть соответственно не менее (Е2 – Е1) или (Е3 – Е2).
до некоторого состояния Е2, или для его перехода из одного возбужденного состояния Е2 в более высокое возбужденное состояние Е3 кинетическая энергия электрона должна быть соответственно не менее (Е2 – Е1) или (Е3 – Е2).
Источником возбуждения оптических спектров служат пламена и электрические разряды, например, дуга, искра и другие, в которых электроны приобретают температуру Т от нескольких тысяч до десятков тысяч К, а исследуемое вещество атомизируется. Электроны совершают хаотическое движение, при котором их средняя кинетическая энергия составляет 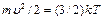 где (k – постоянная Больцмана). В таких условиях частицы приобретают всевозможные скорости: имеются электроны медленные, неспособные возбуждать, и весьма быстрые с энергией в несколько электрон – вольт, достаточной для возбуждения атомов всех элементов. По мере увеличения температуры увеличивается относительное число электронов, имеющие достаточно высокие энергии, и уменьшается доля медленных электронов с энергиями, недостаточными для возбуждения атомов. Чем выше энергия возбуждения атомов, тем выше должна быть температура электронов, чтобы этот процесс проходил эффективно.
где (k – постоянная Больцмана). В таких условиях частицы приобретают всевозможные скорости: имеются электроны медленные, неспособные возбуждать, и весьма быстрые с энергией в несколько электрон – вольт, достаточной для возбуждения атомов всех элементов. По мере увеличения температуры увеличивается относительное число электронов, имеющие достаточно высокие энергии, и уменьшается доля медленных электронов с энергиями, недостаточными для возбуждения атомов. Чем выше энергия возбуждения атомов, тем выше должна быть температура электронов, чтобы этот процесс проходил эффективно.
Взаимодействие с электромагнитным излучением может приводить к ионизации, когда его энергия  . Вероятность каждой ионизации достигает наибольшего значения при энергиях несколько превышающих соответствующую энергию ионизации, а затем она спадает.
. Вероятность каждой ионизации достигает наибольшего значения при энергиях несколько превышающих соответствующую энергию ионизации, а затем она спадает.
Спектры испускания. Дискретная совокупность квантов, которые способны испускать атомы, образуют характеристический линейчатый спектр соответствующего элемента.
 Атомные оптические спектры состоят из весьма большого числа линий, распределенных по широкому участку оптического диапазона длин волн, примерно от 100 до 800 нм.
Атомные оптические спектры состоят из весьма большого числа линий, распределенных по широкому участку оптического диапазона длин волн, примерно от 100 до 800 нм.
Допускаются лишь определенные энергетические переходы в атоме, поэтому спектр каждого элемента состоит из ряда серий, объединяющих линии с общим нижним уровнем (рис 1.2.). В оптическом спектре серии перекрываются. За линиями серии начинается непрерывный спектр рекомбинации, связанный с захватом свободного электрона ионом и его переходом на ее нижний уровень.
При захвате покоящегося электрона испускается квант энергии с частотой 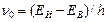 , соответствующий границе серии. Однако ион способен захватывать электрон, имеющий любую кинетическую энергию, которая при этом целиком переходит в излучение. Поэтому спектр рекомбинации содержит непрерывный ряд частот, превышающий частоту границы серии:
, соответствующий границе серии. Однако ион способен захватывать электрон, имеющий любую кинетическую энергию, которая при этом целиком переходит в излучение. Поэтому спектр рекомбинации содержит непрерывный ряд частот, превышающий частоту границы серии:  . Непрерывный рекомбинационный спектр, простирающий за границей серии, создает фон, мешающий анализу, так как он совпадает с линиями и маскирует их.
. Непрерывный рекомбинационный спектр, простирающий за границей серии, создает фон, мешающий анализу, так как он совпадает с линиями и маскирует их.
Спектр испускания принято называть эмиссионным, когда излучающие атомы образуются главным образом при соударении с частицами, и флуоресцентным, когда он образуется под действием излучения.
Спектры поглощения. Совокупность различных порций энергий (квантов), которые способны поглощаться атомами данного элемента при переходе атома с более низкого уровня Е1 на более высокий Еm образует его спектр поглощения, состоящий из большого числа линий, имеющих длину волны 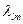 и частоты
и частоты 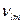 зависящие от разности энергий обоих уровней.
зависящие от разности энергий обоих уровней.
Спектр поглощения характеристичен в той же степени, что спектр испускания, поскольку он определяется той же системой атомных энергетических состояний.
Для обозначения линии пользуются символом элемента, индексом кратности иона (обозначаемым римской цифрой) и длиной волны в нанометрах например, Na 1 589,59 нм, Fe ІІ 2 261,38 нм, (где индекс 1 относится к нейтральному атому, ІІ - к однозарядному иону и т.д.).
Число линий, а, следовательно, и сложность спектра возрастают в следующем порядке: наиболее простые спектры – у водорода и других элементов с одним валентным электроном, т.е. у щелочных металлов; более сложны спектры имеют элементы второй группы, затем спектры усложняются по мере увеличения номера группы. Самые сложные спектры у элементов с недостроенными d -, f - оболочками, т.е. у металлов всех побочных подгрупп, кроме трех первых, и у редкоземельных элементов. Все элементы главных групп периодической таблицы имеют относительно простые спектры. Например, у цветных металлов – простые спектры, у черных и редкоземельных – сложные.
Линейчатый спектр сложного вещества складывается из характеристических спектров отдельных его атомов и ионов.
Для анализа химического состава вещества выделяют при помощи спектральных приборов из сложного спектра отдельные наиболее подходящие для данного случая линии определяемых элементов.
Для спектрального анализа особое значение имеют резонансные линии, так как теоретически они обеспечивают наибольшую чувствительность анализа. Резонансные линии – эти линии испускаются или поглощаются при переходах между основным энергетическим уровнем и самым низким возбужденным уровнем.
1.5. Аппаратура для изучения спектров
Спектральные приборы являются инструментом для исследования микромира атомов и молекул. Изменение энергетического состояния атома (молекулы) сопровождается излучением или поглощением квантов света. Энергия кванта  определяет положение спектральной линии на шкале электромагнитных колебаний, а число квантов – ее интенсивность. Изучая с помощью спектральных приборов спектр и интенсивность спектральных линий, можно получать обширную информацию об энергетических состояниях атомов (молекул) и определять концентрацию вещества.
определяет положение спектральной линии на шкале электромагнитных колебаний, а число квантов – ее интенсивность. Изучая с помощью спектральных приборов спектр и интенсивность спектральных линий, можно получать обширную информацию об энергетических состояниях атомов (молекул) и определять концентрацию вещества.
Для атомного спектрального анализа применяют большей частью дисперсионные спектральные приборы, основными элементами которых являются призмы или дифракционные решетки.
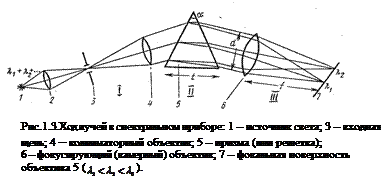
Оптические схемы дисперсионных приборов. Дисперсионные приборы (рис.1.3.) состоят из трех основных частей: 1 – коллиматора, ІІ – диспергирующего элемента, ІІІ – узла с фокусирующим объективом 5. Эти три части прибора жестко связаны друг с другом, крепятся на массивном основании и заключены в кожухи, защищающие их от постороннего света. Входной коллиматор имеет узкую щель 2 и объектив 3, главная ось которого проходит через центр щели. Второй узел содержит одну или несколько диспергирующих призм 4 или же отражающую дифракционную решетку. Щель параллельно преломляющему ребру призмы или штрихам решетки; ширина щели регулируется в пределах 0 – 0,4 мм.
Если прибор предназначается для фотографирования спектра, то с фокальной поверхностью 6 фокусирующего объектива 5 совмещен светочувствительный слой пластинки или пленки, которые вставляют в кассету; плоскость светочувствительного слоя параллельна входной щели.
Прибор с фотографической регистрацией называют спектрографом, с визуальной регистрацией – спектроскопом, стилоскопом или стилометром (в зависимости от назначения и способа измерения интенсивности линий).
Ход лучей в спектральном приборе показан на рис.1.3.
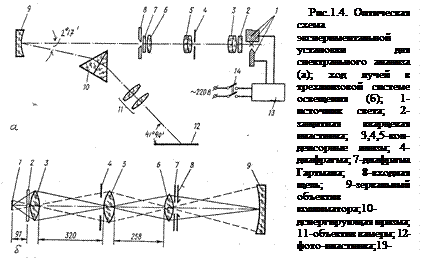
В данной работе используется кварцевый спектрограф ИСП – 28. Этот прибор является прибором средней дисперсии, дает высокое качество спектра и широко применяется для качественного и количественного спектрального анализа сплавов, руд и минералов. Оптическая схема показана на рис.1.4
В спектрографе ИСП–28 диспергирующее устройство состоит из призмы Карню 10, коллиматор состоит из зеркального объектива 9 и щели 8. Для получения параллельного пучка щель 8 обычно помещается в фокальной плоскости зеркального объектива, который представляет собой сферическое зеркало с наружным отражающим слоем. Фокусное расстояние коллиматорного объектива одинаково для всех длин волн, в данном случае 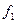 =703 мм. Угол между оптической осью светового пучка, падающего на коллиматорный объектив и оптической осью пучка, отраженного от коллиматорного объектива 2
=703 мм. Угол между оптической осью светового пучка, падающего на коллиматорный объектив и оптической осью пучка, отраженного от коллиматорного объектива 2 17’. Камера состоит из двух кварцевых линз 11 и кассеты 12. Наблюдаемые визуально и фотографически спектральные линии представляют собой монохроматические изображения входной щели, образованные оптической системой спектрографа. Совокупность этих монохроматических изображений входной щели называется спектром. Фокусное расстояние камерного объектива зависит от длины волны света. Для длины
17’. Камера состоит из двух кварцевых линз 11 и кассеты 12. Наблюдаемые визуально и фотографически спектральные линии представляют собой монохроматические изображения входной щели, образованные оптической системой спектрографа. Совокупность этих монохроматических изображений входной щели называется спектром. Фокусное расстояние камерного объектива зависит от длины волны света. Для длины  =257,3 нм величина
=257,3 нм величина 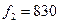 мм. Для освещения щели применяется трехлинзовая конденсорная система, действие которой пояснено на рис 1.4.(б).
мм. Для освещения щели применяется трехлинзовая конденсорная система, действие которой пояснено на рис 1.4.(б).
 Барабан на щели служит для изменения ширины щели, которое производится с точностью до 0,001 мм. Под щелью имеется механизм юстировки объектива. Чтобы спектры снимались на одной пластинке и при переходе от известного спектра к исследуемому не приходилось смещать пластинку, пользуются специальной диафрагмой (рис.1.5). Эта диафрагма устанавливается перед щелью спектрографа в специальной оправе и может перемещаться в направлении, перпендикулярном оптической оси спектрографа. С помощью подобной диафрагмы можно не только ограничить высоту щели, но и осветить различные ее участки.
Барабан на щели служит для изменения ширины щели, которое производится с точностью до 0,001 мм. Под щелью имеется механизм юстировки объектива. Чтобы спектры снимались на одной пластинке и при переходе от известного спектра к исследуемому не приходилось смещать пластинку, пользуются специальной диафрагмой (рис.1.5). Эта диафрагма устанавливается перед щелью спектрографа в специальной оправе и может перемещаться в направлении, перпендикулярном оптической оси спектрографа. С помощью подобной диафрагмы можно не только ограничить высоту щели, но и осветить различные ее участки.
 Спектрограф снабжен миллиметровой шкалой, которая может быть непосредственно впечатана на фотографическую пластинку одновременно со спектром. Эта миллиметровая шкала, в свою очередь, должна быть градуирована в единицах длин волн при помощи спектра – эталона. Обычно в качестве такого стандартного эталонного спектра используется спектр железа, обладающим большим числом спектральных линий, длины волн которых измерены с большой точностью (до 3-го и 4-го десятичных знаков).
Спектрограф снабжен миллиметровой шкалой, которая может быть непосредственно впечатана на фотографическую пластинку одновременно со спектром. Эта миллиметровая шкала, в свою очередь, должна быть градуирована в единицах длин волн при помощи спектра – эталона. Обычно в качестве такого стандартного эталонного спектра используется спектр железа, обладающим большим числом спектральных линий, длины волн которых измерены с большой точностью (до 3-го и 4-го десятичных знаков).
Источники света. Для получения спектров испускания атомов и простых молекул используются различные источники света. Наиболее распространенным источником линейчатых и полосатых спектров является активизированная дуга переменного тока, в плазме которой развивается температура до нескольких тысяч градусов. Если подвести переменный ток к металлическим электродам, то дуга между ними не возникает, т.к. в паузах тока электроды успевают остыть настолько, что прекращается термоэлектронная эмиссия.
Чтобы дуга переменного тока не гасла, ее активируют высокочастотным (ВЧ) разрядом малой мощности и высокого напряжения (10000-12000 В), который ионизирует дуговой промежуток.
Электрическая схема активированной дуги переменного тока приведена на (рис 1.6.).
 Высокая частота вводится в цепь переменного тока (220 В и 50 Гц), питающую дуговой разряд (контур II) с помощью индукционной катушки 2, которая связана с ВЧ контуром 1. Контур питается от трансформатора небольшой мощности 1, напряжение которого регулируется сопротивлением 5. Цепь вторичной обмотки замкнута через конденсатор 7. По мере появления напряжения сети в начале каждого полупериода (т.е. 100 раз в с), конденсатор заряжается. Зарядка продолжается до тех пор, пока напряжение на нем не достигнет напряжения пробоя вспомогательного разрядного промежутка 3. В этом контуре возникают затухающие ВЧ колебания, которые через повышающую индукционную катушку 2, подается на разрядный промежуток дуги 4, где происходит ионизация. 8 предназначена для закорачивания токов ВЧ.
Высокая частота вводится в цепь переменного тока (220 В и 50 Гц), питающую дуговой разряд (контур II) с помощью индукционной катушки 2, которая связана с ВЧ контуром 1. Контур питается от трансформатора небольшой мощности 1, напряжение которого регулируется сопротивлением 5. Цепь вторичной обмотки замкнута через конденсатор 7. По мере появления напряжения сети в начале каждого полупериода (т.е. 100 раз в с), конденсатор заряжается. Зарядка продолжается до тех пор, пока напряжение на нем не достигнет напряжения пробоя вспомогательного разрядного промежутка 3. В этом контуре возникают затухающие ВЧ колебания, которые через повышающую индукционную катушку 2, подается на разрядный промежуток дуги 4, где происходит ионизация. 8 предназначена для закорачивания токов ВЧ.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1151; Нарушение авторских прав?; Мы поможем в написании вашей работы!