
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модель атома Томсона. Опыты Резерфорда. Планетарная модель атома
|
|
|
|
Модель Томсона (иначе называемая «пудинговая модель атома») — модель атома, предложенная в 1904 году Джозефом Джоном Томсоном. Открыв в 1897 году электрон, Томсон предположил, что «корпускулы»(так Томсон называл электроны, хотя ещё в 1894 году Дж. Дж. Стоуни предложил называть «атомы электричества» электронами) являются составными частями атома и решил создать модель атома, отражающую это предположение.
С точки зрения Томсона:
…атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд…[2]
Атом по Томсону состоит из электронов, помещённых в положительно заряженный «суп», компенсирующий отрицательные заряды электронов, подобно отрицательно заряженным «изюминкам» в положительно заряженном «пудинге». Электроны, как предполагалось, были распределены по всему атому. Было несколько вариантов возможного расположения электронов внутри атома, в частности вращающиеся кольца электронов. В некоторых вариантах модели вместо «супа» предлагалось «облако» положительного заряда.
Согласно этой модели, электроны могли свободно вращаться в капле или облаке такой положительно заряженной субстанции. Их орбиты стабилизировались тем, что, при удалении электрона от центра положительно заряженного облака, он испытывал увеличение силы притяжения, возвращающей его обратно, поскольку внутри его орбиты было больше вещества противоположного заряда, чем снаружи (по закону Гаусса). В модели Томсона электроны могли свободно вращаться по кольцам, которые стабилизировались взаимодействиями между электронами, а спектры объясняли энергетические различия между различными кольцевыми орбитами.
Статья Томсона была опубликована в марте 1904 года в Философском журнале (Philosophical Magazine), ведущем британском научном журнале того времени. Томсон позднее пытался объяснить с помощью своей модели яркие спектральные линии некоторых элементов, но не особо в этом преуспел.
Тем не менее, модель Томсона (также как подобная модель сатурнианских колец для электронов атомов, которую выдвинул тоже в 1904 году Нагаока, по аналогии с моделью колец Сатурна Джеймса Клерка Максвелла) стала ранним предвестником более поздней и более успешной модели Бора, представляющей атом как подобие Солнечной системы.
Модель атома Томсона 1904 года была опровергнута в эксперименте по рассеянию альфа-частиц на золотой фольге в 1909 году, который был проанализирован Эрнестом Резерфордом в 1911 году[3] [4], предположившим, что в атоме есть очень малое ядро, содержащее очень большой положительный заряд (в случае золота, достаточный, чтобы компенсировать заряд около 100 электронов), что привело к созданию планетарной модели атома Резерфорда. Хотя атомный номер золота равен 79, сразу же после появления статьи Резерфорда в 1911 году Антониус Ван ден Брук сделал интуитивное предположение, что атомный номер и является зарядом ядра. Для решения вопроса требовался эксперимент. В 1913 году Генри Мозли экспериментально показал (см. Закон Мозли), что эффективный заряд ядра очень близок к атомному номеру (разность, обнаруженная Мозли, была не больше единицы), причём Мозли ссылался только на работы Ван ден Брука и Резерфорда. Эта работа в итоге привела к созданию в том же году модели атома Бора, похожей на Солнечную систему (но с квантовыми ограничениями), в которой ядро, имеющее положительный заряд, равный атомному номеру, окружено равным числом электронов на орбитальных слоях.
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 6.1.2.
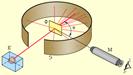
|
| Рисунок 6.1.2. Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп |
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Планетарная модель атома, или модель Резерфорда, - историческая модель строения атома, которую предложил Эрнест Резерфорд в результате эксперимента с рассеиванием альфа-частиц. По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны, - подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики. Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга» Джозефа Джона Томсона, которая постулирует, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2782; Нарушение авторских прав?; Мы поможем в написании вашей работы!