
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изучение спектральных закономерностей с помощью монохроматора УМ – 2
|
|
|
|
Лабораторная работа № 6
Цель работы: определить длины волн спектров испускания и спектров поглощения различных веществ с помощью монохроматора УМ-2.
Оборудование: универсальный монохроматор УМ-2, ртутно-кварцевая лампа ПРК, лампа накаливания, растворы крови, хлорофилла, красящих веществ, светофильтры, спиртовка.
В оптическом диапазоне электромагнитных волн обычно выделяют следующие виды спектров:
Спектры испускания, которые получаются от источников света при разложении их излучения по длинам волн (l) спектральными приборами и характеризуются функцией f (l), дающей распределение энергии испускаемого света в зависимости от длины волны. Можно перейти к функции j (n), дающей распределение энергии по частотам.
Спектры поглощения, которые обычно получаются при прохождении света через вещество с последующим его разложением по l. В последнем случае выделяют спектры отражения и спектры рассеяния.
Спектры поглощения, рассеяния и отражения характеризуются долей энергии соответствующей поглощенной К (l), рассеянной a (l) и отраженной R (l) частям. Атомы данного химического элемента поглощают те спектральные линии (точнее частоты), которые они сами испускают. Газовая оболочка, окружающая Солнце, — хромосфера и земная атмосфера поглощают ряд линий в непрерывном спектре излучения Солнца и в сплошном спектре Солнца наблюдаются многочисленные темные фраунгоферовы линии.
Оптические спектры регистрируются с помощью фотографических методов, применяют также счетчики фотонов для УФ области, термоэлементы в ИК-области и т.д. В видимой области оптические спектры можно наблюдать визуально. По виду оптические спектры разделяют на линейчатые, полосатые и сплошные.
Линейчатые (атомные) спектры состоят из отдельных спектральных линий, получающихся при испускании или поглощении электромагнитного излучения свободными или слабо связанными атомами (например, в газах или парах).
Спектральные линии имеют определенную интенсивность и отделены одна от другой темными промежутками. Изолированные атомы химического элемента излучают вполне определенную, присущую только этому химическому элементу, совокупность спектральных линий. Частота излучения n соответствует определенному квантовому переходу между уровнями энергии Е n и Е m атома согласно соотношению: 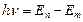 . Например, спектр излучения атома водорода является линейчатым. Частоты линий этого спектра описываются формулой Бальмера-Ридберга:
. Например, спектр излучения атома водорода является линейчатым. Частоты линий этого спектра описываются формулой Бальмера-Ридберга:
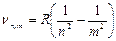 ,
,
где 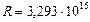 с-1 называется постоянной Ридберга, целые числа n и m называются главными квантовыми числами, причем
с-1 называется постоянной Ридберга, целые числа n и m называются главными квантовыми числами, причем 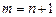 ,
,  и т.д. Группа спектральных линий с одинаковым значением n называется серией спектральных линий. Наибольшая частота для каждой серии с главным квантовым числом n соответствует значению m =¥ и называется границей серии (рис. 1а).
и т.д. Группа спектральных линий с одинаковым значением n называется серией спектральных линий. Наибольшая частота для каждой серии с главным квантовым числом n соответствует значению m =¥ и называется границей серии (рис. 1а).
В зависимости от значений n и m в спектре атома водорода наблюдаются следующие сериальные закономерности Лаймана, Бальмера (рис. 1а), Пашена, Брэкета, Пфунда, Хемфри. Первая серия находится в далекой ультрафиолетовой части спектра. Вторая серия (серия Бальмера) – в видимой части спектра. Все остальные находятся в инфракрасной части спектра.
Полосатые (молекулярные) спектры возникают при квантовых переходах молекул с одного энергетического уровня на другой. В молекулярных спектрах проявляются закономерности трех типов: 1) объединение отдельных линий в полосу; 2) объединение полос в группы; 3) наличие в спектре нескольких групп полос (рис.1б).
Энергия Е молекулы, определяющая ее спектр, состоит из трех частей:
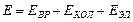 ,
,
где Е вр — энергия вращательного движения молекулы как целого вокруг некоторых осей; Е кол — энергия колебательного движения ядер атомов, входящих в молекулу; Е эл — энергия движения электронов в атомах молекул.
Каждое из трех слагаемых Е изменяется дискретно. Изменения соответствующих частей энергии молекулы D Е вр, D Е кол и D Е эл имеют также дискретные значения. Суммарное изменение энергии определяется выражением:
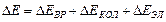 .
.
По правилу Бора частота кванта n, который испускает молекула при изменении ее энергетического состояния, определяется формулой:
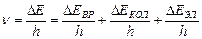 .
.
Как показывают опыты и теоретические расчеты
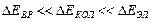 .
.
Сплошной спектр получается от раскаленных твердых тел. Известно, что при образовании твердого тела однотипные электронные уровни, сближаясь, образуют зоны, в которых количество возможных электронных переходов значительно превышает число переходов в отдельно существующих молекулах или атомах. Сплошной спектр представляет собой цветную полосу, в которой красный цвет непрерывно переходит в оранжевый, оранжевый в желтый и т.д.
Таблица 1.
| Наименование цветов спектра | Предел длины волн в нм (1 нм = 10-9 м) |
| Фиолетовый | 400 — 440 |
| Синий и голубой | 440 — 495 |
| Зеленый | 495 — 580 |
| Желтый и оранжевый | 580 — 640 |
| Красный | 640 — 760 |
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 551; Нарушение авторских прав?; Мы поможем в написании вашей работы!