
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сульфат меди –средняя, нормальная соль
|
|
|
|
Слева – степени окисления, справа – пример молекулярной формы. Жирным шрифтом выделено наиболее устойчивое, характерное состояние элемента.
Китай
Япония
Традиционной характеристикой японского рынка труда является система трудовых отношений, основанная на пожизненном найме работников. При таком подходе постоянный (штатный) работник гарантированно занят на предприятии до достижения им возраста 55—60 лет, повышение размеров его заработной платы, премиальных и социальных выплат осуществляется в прямой зависимости от числа проработанных лет, плановое последовательное повышение квалификации и служебно-профессиональный рост — в зависимости от возраста сотрудника. В таком виде японская модель рынка труда существовала достаточно долго и показала свою эффективность в период восстановления экономики после Второй мировой войны.
В 1970—1980-е гг. проявились недостатки системы пожизненного найма, т.к. затраты на содержание штата в условиях гарантированной занятости чрезвычайно высоки и не всегда обеспечивают эффективность организации, что в свою очередь вынуждает предприятия принимать меры по сокращению штата.
Отсутствие гибкого рынка труда, обеспечивающего потребности общественного производства, развивающегося в условиях глобализации и продолжающегося научно-технического прогресса, стало одной из причин длительного экономического кризиса в Японии. Рост безработицы, ухудшение демографической ситуации, характеризующейся угрожающим старением населения, вызванным снижением рождаемости, высокий уровень безработицы среди молодежи, вдвое превышающий средний по стране, закрытость внутреннего рынка труда для мигрантов, потребовало изменений в сфере регулирования занятости.
Решение указанных проблем специалисты связывают с проведением молодежной политики в сфере занятости, стимулированием трудоустройства пенсионеров и женщин, а также развитием новых форм занятости.
Проблемы молодежной занятости решаются различными организациями инфраструктуры рынка труда — и государственными, финансируемыми за счет госбюджета, и негосударственными, осуществляющими свою деятельность с привлечением различных источников финансирования, в том числе от общественных и благотворительных организаций. Так в Японии действуют курсы профессионального обучения и производственной практики, центры и так называемые кафе по трудоустройству молодежи, школы вакансий. Кроме того, в Японии недавно была увеличена возрастная граница выхода на пенсию — 65 лет и для мужчин, и для женщин. Для данной страны такой подход вполне оправдан, поскольку там отмечается самая высокая продолжительность жизни населения в мире.
В настоящее время в Японии широкое распространение получили гибкие формы занятости:
• занятость неполный рабочий день;
• временный найм на работу по контракту с испытательным сроком, который может продолжаться несколько лет;
• занятость на основе деления рабочего времени или рабочего места;
• дистанционная занятость, расширяющая возможности трудоустройства женщин, пенсионеров, молодежи, людей, живущих на значительном расстоянии от места работы и тратящих много времени на дорогу.
Таким образом, рынок труда современной Японии характеризуется процессами перехода от традиционной модели занятости к ее формам, обеспечивающим гибкость и мобильность рабочей силы, а также проведением политики вовлечения населения различных социально-демографических групп в сферу занятости.
Китай — самое значительное по численности населения государство мира. Обладая практически неограниченными трудовыми ресурсами, оно вместе с тем сталкивается с серьезными проблемами в сфере занятости и рынка труда.
Рост внутренней миграции привел к формированию стихийного рынка труда, где практически сразу определились следующие противоречия:
• избыток рабочей силы из сельских районов при нехватке рабочих мест в городах;
• ориентация среди безработных на трудоустройство на государственные предприятия, при этом спрос на рабочую силу формируется в основном за счет малого и среднего бизнеса — сфера услуг, торговля, строительство и т.д.;
• низкая квалификация рабочей силы при значительном снижении доли ручного труда и внедрении высокоэффективных трудосберегающих технологий;
• количество новых рабочих мест не сопоставимо с темпами роста численности трудоспособного населения.
Правительство Китая предпринимало различные меры по снятию напряженности на рынке труда, в частности, путем ограничения переселения крестьян в города, поддержки различных форм частного предпринимательства, например семейного подряда. Однако большая часть функций в сфере занятости по-прежнему остается в ведении государственных предприятий: на многих из них были выделены определенные категории работающих, по которым они не включались в списки для сокращения. Например, нельзя увольнять мужчин в возрасте старше 55 лет и женщин старше 50 лет, членов семей военных; может быть сокращен только один из работающих супругов и т.д. В 2000 г. предложение рабочей силы на рынке труда страны превысило потребность на 183,5 млн чел. В настоящее время примерно четверть трудоспособных горожан и крестьян полностью или частично безработные. Ситуация осложняется тем, что в Китае фактически отсутствуют институты рынка труда, система страхования от безработицы, учебные заведения профессионального образования не обеспечивают возможности подготовки для безработных.
Помимо этого, китайские специалисты считают, что для регулирования безработицы на данном этапе необходимо применение следующих мер: формирование институтов (системы социального страхования, страхования по безработице, трудового законодательства) и инфраструктуры рынка труда, адекватных рыночной экономике, контроль уровня безработицы на государственном уровне, введение сокращенных режимов работы и гибких форм занятости на предприятиях, обеспечение первоочередного трудоустройства квалифицированных работников в соответствии с их профессиональной подготовкой, организация общественных работ, содействие межрегиональной миграции рабочей силы и др.
Вместе с тем руководство Китая осознает, что проблемы в сфере занятости в стране, где человеческие ресурсы огромны, а количество рабочих рук избыточно, не могут быть решены в полной мере без свободной трудовой миграции. Некоторые китайские провинции уже в течение нескольких лет «экспортируют» рабочую силу, в частности в Российскую Федерацию.
Водород Кислород
+1 _______ H2O +2 _______ F2O
0 _______ H2 0 _______ O2
-1_______ NaH (гидриды) -1_______ H2O2 (пероксиды)
-2 _______ H2O
Хлор Азот
+7 _______ HCIO4 +5 _______ HNO3
+5 _______ HCIO3 +4 _______ NO2
+3 _______ HCIO2 +3 _______ HNO2
+1 _______ HCIO +2 _______ NO
0 _______ CI2 +1 _______ N2O
-1 _______ HCI 0 _______ N2
-3_______ NH3
Сера Железо
+6 _______ H2SO4 +6 _______ Na2FeO4
+4 _______ H2SO3 +3 _______ Fe2O3
0 _______ S +2 _______ FeO
-2_______ H2S 0 _______ Fe
Хром Марганец
+6 _______ H2CrO4 +7_______ HMnO4
+3 _______ Cr(OH)3 +6 _______ H2MnO4
+2 _______ CrO +4_______ MnO2
0_______ Cr +2 _______ Mn(OH)2
0_______Mn.
Водород – восстановитель, в большинстве соединений устойчив в состоянии +1. Кислород – сильный окислитель, переходит в самое характерное состояние -2. Все кислородные соединения хлора в положительных степенях окисления неустойчивы, взрывают, реакции направлены в наиболее устойчивую форму хлора -1. Молекулярный азот N2 является практически инертным газом, не вступает в реакции, это самая устойчивая форма азота.
Первый тип химических процессов называется реакциями кислотно-основными. В таких реакциях степени окисления всех элементов остаются без изменения, СО=const, например:
+4 +4
SO2 + H2O = H2SO3
+6 +6
SO3 + H2O = H2SO4
Это достаточно простые реакции нейтрализации, оксид + оксид, оксид + кислота, соль +соль (обмен), соль + вода (гидролиз) др. Свойство вещества быть кислотой – одно из важнейших. Какие же вещества называют в химии кислотами?
Общие свойства кислот: 1) кислый вкус; 2) обнаружение индикаторами; 3)нейтрализация щелочами; 4) выделение водорода с металлами.
Общие свойства оснований: 1) горький вкус; 2) нейтрализация кислотами; 3)мыльные на ощупь; 4) обнаружение индикаторами.
Представим фрагмент молекулы …Э – О – Н. Возможны три варианта:
1. Э = CI, S, N. …S – О – Н ® …S – O – + H+. Это диссоциация по кислотному типу с отщеплением в водном растворе ионов водорода. Кислоты различают одно- и многоосновные. Основность – число атомов водорода, способных замещаться на металл. Речь идет не о всех атомах водорода, например уксусная кислота CH3COOH одноосновна, способна отщеплять в водном растворе только один атом водорода гидроксильной группы. Остальные атомы водорода метильной группы прочно связаны ковалентными связями с углеродом и не могут диссоциировать, проявлять кислотные свойства.
2. Э = Na, K, Ca NaOH ® Na+ + OH–. Диссоциация в водном растворе по типу типичного основания с отщеплением гидроксил-иона.
3. Э = AI, Zn, Sn, Pb. Возможна диссоциация как по типу кислоты, так и основания, оба процесса равновероятны, так как степень поляризации связей металл-кислород и кислород-водород примерно одинакова. В предыдущих случаях происходил разрыв более полярной связи с большей долей ионности.
2H+ + ZnO22– Û Zn(OH)2 Û Zn2+ 2 OH –.
Такие основания называются амфотерными, для них характерно двойственное поведение: с кислотами они проявляют основные свойства, а с основаниями – кислотные свойства:
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O;
H2ZnO2 + NaOH = Na2ZnO2 + 2H2O.
Продуктами взаимодействия кислот и оснований являются соли. При полном замещении атомов водорода кислоты на металл получаются средние или нормальные соли:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O.
O
Cu < >S = O
O ½½
O
Cu(OH)2 + 2H2SO4 = Cu(НSO4)2 + 2H2O.
Гидросульфат меди – кислая соль, образуется в условиях избытка кислоты. Эти соли лучше растворяются в воде, чем средние, так например нерастворимый карбонат кальция растворяется в воде, насыщенной углекислым газом:
CaCO3 + CO2 + H2O = Ca(HCO3)2
В условиях избытка основания образуются нерастворимые в воде основные соли:
2Cu(OH)2 + H2SO4 = (CuОН) 2SO4 + 2H2O.
Гидроксосульфат меди
Cu(OH)2 – (CuОН) 2SO4 – CuSO4 – Cu(НSO4)2 – H2SO4
®®® при добавлении серной кислоты
¬¬¬ при добавлении гидроксида меди.
Вторым типом химических процессов являются более сложные реакции с изменением степеней окисления, они называются окислительно-восстановительными. Окисление – отдача электронов, в процессе восстановления окислителя степень его окисления должна всегда уменьшаться:
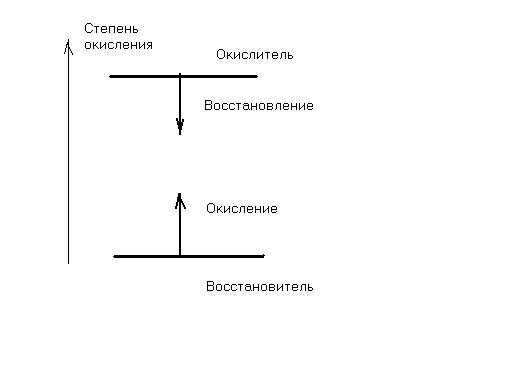
Рис.2.1 Направленность изменения степеней окисления.
Степень окисления восстановителя в процессе окисления должна всегда расти.
Сильные окислители: F2, O2, O3, CI2, Br2, HCIO – HCIO4, H2O2, пероксиды металлов, H2SO4конц, HNO3, PbO2, KMnO4, K2Cr2O7, KBiO3. Из простых веществ это самый сильный фтор, хлор, кислород. Все кислородные соединения галогенов в положительных степенях окисления. Пероксиды со степенью окисления кислорода минус один. Крепкая серная кислота за счет серы плюс шесть. Азотная кислота проявляет сильные окислительные свойства в любых концентрациях за счет атома азота плюс пять. Высшие степени окисления свинца (+4), хрома (+6), марганца (+7), висмута (+5) – сильнейшие окислители
Сильные восстановители: углеводороды, альдегиды, активные металлы, H2, C, CO, CrO, HBr, HI, H2S, NH3, PH3, NaH. Из простых веществ это водород, углерод (кокс) и активные металлы (щелочные, щелочноземельные, алюминий и др.). Металлические свойства связаны прежде всего со способностью элемента легко отдавать электроны, то есть быть активным восстановителем. Углерод и хром в состоянии +2, бромисто- и иодистоводородные кислоты в степени окисления минус один, сера (–2), азот (–3), фосфор (–3) и водород (–1) в низших степенях окисления. Из органических веществ все виды углеводородных топлив, способных легко окисляться, то есть гореть с выделением тепла, а также альдегиды.
Различают три типа окислительно-восстановительных процессов:
а) межмолекулярные реакции.
0 0 +3 –1 2 Fe - 3e ® Fe +3
2Fe + 3CI2 = 2FeCI3 3 CI2 + 2e ® 2CI-1
Есть молекула окислитель (хлор) и молекула восстановитель (железо), происходит перенос электронов от восстановителя на окислитель. Электроны не исчезают и не берутся извне, поэтому число отдаваемых электронов равно числу присоединяемых, «два» и «три» есть окислительно-восстановительные коэффициенты уравнения реакции. Таким путем могут быть подобраны коэффициенты любой, самой сложной реакции (электронный метод).
Другой пример взаимодействия азотной кислоты с металлической медью. Азотная кислота выполняет роль окислителя, в реакциях с металлами образуются различные продукты ее восстановления (азота +5), это зависит от ряда факторов (температуры, концентрации кислоты, активности металла), очень часто выделяется бурый газ диоксид азота:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Cu - 2e ® Cu 2+ 1
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2167; Нарушение авторских прав?; Мы поможем в написании вашей работы!