
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Ван-дер-Ваальса
|
|
|
|
Реальные газы
Поведение реальных газов при их малых плотностях хорошо описывается уравнением Клапейрона:
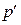
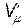 = RT, (11.1)
= RT, (11.1)
где 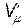 - объем моля газа,
- объем моля газа, 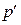 - давление идеального газа, T - температура. Однако при давлениях порядка 200 атм. отклонение от уравнения (11.1) составляет около 5%. Это отклонение вызвано влиянием сил притяжения между молекулами и наличием собственного объема молекул. Для учета собственного объема молекул нидерландский физик Ван-дер-Ваальс ввел поправку b и представил объем, свободный для движения, в виде
- давление идеального газа, T - температура. Однако при давлениях порядка 200 атм. отклонение от уравнения (11.1) составляет около 5%. Это отклонение вызвано влиянием сил притяжения между молекулами и наличием собственного объема молекул. Для учета собственного объема молекул нидерландский физик Ван-дер-Ваальс ввел поправку b и представил объем, свободный для движения, в виде 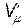 = Vm - b. Уравнение (11.1) запишется в виде
= Vm - b. Уравнение (11.1) запишется в виде
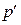 (Vm - b) = RT, (11.2)
(Vm - b) = RT, (11.2)
где Vm - объем моля реального газа.
Силы притяжения со стороны других молекул вызывают уменьшение скорости молекулы, соударяющейся со стенкой, поэтому силы взаимодействия молекул уменьшают давление газа на стенки сосуда на величину pi . Давление реального газа запишется в виде p = 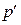 - pi и формула (11.2) будет иметь вид:
- pi и формула (11.2) будет иметь вид:
(p + p i )·(Vm - b) = RT. (11.3)
Величина pi зависит от объема газа. Если рассмотреть две половинки малого объема газа, то при увеличении количества молекул в них в n раз сила их взаимодействия f увеличится в n2 раз (рис. 11.1). Следовательно, величина pi ~ r 2, где r - плотность газа. Учитывая, что при неизменной массе газа величина r обратно пропорциональна объему V, получим pi = a / 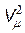 . Выражение (11.3) запишется в виде
. Выражение (11.3) запишется в виде
(p + a / 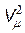 )(Vm - b) = RT, (11.4)
)(Vm - b) = RT, (11.4)
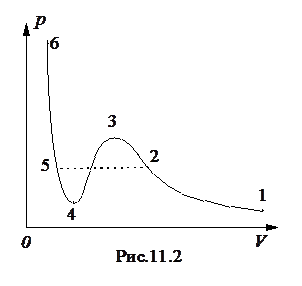 где a - поправка Ван-дер-Ваальса, учитывающая притяжение молекул. Формулу (11.4.) называют уравнением Ван-дер-Ваальса. Это уравнение гораздо лучше согласуется с экспериментом, чем уравнение Клапейрона. Изотерма Ван-дер-Ваальса построена на рис. 11.2. Она отличается от изотермы идеального газа наличием S -образного участка 2-3-4-5, который обычно не реализуется на опыте. Если взять некоторый газ, состояние которого соответствует точке 1, и изотермически сжимать его, то уравнение Ван-дер-Ваальса на участке 1-2 будет хорошо описывать опытную кривую. При дальнейшем сжатии газа экспериментальная кривая пройдет по штриховой линии 2-5. В точке 2 газ является насыщенным паром, и при дальнейшем уменьшении его объема часть пара конденсируется. Система распадается на две фазы: жидкую и газообразную. Давление насыщенного пара является постоянным и линия 2-5 параллельна оси абсцисс. При уменьшении объема системы по линии 2-5 растет количество жидкой фазы, и в точке 5 насыщенный пар полностью конденсируется в жидкость. Жидкость является малосжимаемой, поэтому при дальнейшем уменьшении объема давление быстро возрастает. Участок 5-6 изотермы Ван-дер-Ваальса полностью совпадает с опытной кривой. S‑ образный участок изотермы, представляющий собой область неустойчивых состояний, на опыте обычно на реализуется. Участок 3-4 представляет собой область совершенно неустойчивых состояний и экспериментально его невозможно реализовать. При некоторых условиях, например, отсутствии центров конденсации или кипения, можно реализовать участки 2-3 и 4-5. Участок 2-3 соответствует перегретому пару, а участок 4-5 - перегретой или растянутой жидкости. Эти вполне устойчивые состояния называются метастабильными, и если искусственно ввести в метастабильную систему центры конденсации, то система скачком перейдет в двухфазное состояние. Воду можно перегреть на несколько десятков градусов, и если насыпать в нее немного мелкого песка, то происходит вскипание со взрывом. При перегонке многих жидкостей с целью очистки во избежание перегрева необходимо вводить специальные предметы в качестве центров кипения. Метастабильные состояния жидкости и пара широко используются при регистрации элементарных частиц.
где a - поправка Ван-дер-Ваальса, учитывающая притяжение молекул. Формулу (11.4.) называют уравнением Ван-дер-Ваальса. Это уравнение гораздо лучше согласуется с экспериментом, чем уравнение Клапейрона. Изотерма Ван-дер-Ваальса построена на рис. 11.2. Она отличается от изотермы идеального газа наличием S -образного участка 2-3-4-5, который обычно не реализуется на опыте. Если взять некоторый газ, состояние которого соответствует точке 1, и изотермически сжимать его, то уравнение Ван-дер-Ваальса на участке 1-2 будет хорошо описывать опытную кривую. При дальнейшем сжатии газа экспериментальная кривая пройдет по штриховой линии 2-5. В точке 2 газ является насыщенным паром, и при дальнейшем уменьшении его объема часть пара конденсируется. Система распадается на две фазы: жидкую и газообразную. Давление насыщенного пара является постоянным и линия 2-5 параллельна оси абсцисс. При уменьшении объема системы по линии 2-5 растет количество жидкой фазы, и в точке 5 насыщенный пар полностью конденсируется в жидкость. Жидкость является малосжимаемой, поэтому при дальнейшем уменьшении объема давление быстро возрастает. Участок 5-6 изотермы Ван-дер-Ваальса полностью совпадает с опытной кривой. S‑ образный участок изотермы, представляющий собой область неустойчивых состояний, на опыте обычно на реализуется. Участок 3-4 представляет собой область совершенно неустойчивых состояний и экспериментально его невозможно реализовать. При некоторых условиях, например, отсутствии центров конденсации или кипения, можно реализовать участки 2-3 и 4-5. Участок 2-3 соответствует перегретому пару, а участок 4-5 - перегретой или растянутой жидкости. Эти вполне устойчивые состояния называются метастабильными, и если искусственно ввести в метастабильную систему центры конденсации, то система скачком перейдет в двухфазное состояние. Воду можно перегреть на несколько десятков градусов, и если насыпать в нее немного мелкого песка, то происходит вскипание со взрывом. При перегонке многих жидкостей с целью очистки во избежание перегрева необходимо вводить специальные предметы в качестве центров кипения. Метастабильные состояния жидкости и пара широко используются при регистрации элементарных частиц.
Итак, уравнение Ван-дер-Ваальса позволило предсказать наличие неустойчивых состояний и неплохо количественно описать переход вещества из газообразного состояния в жидкое.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 371; Нарушение авторских прав?; Мы поможем в написании вашей работы!