
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрофильное замещение в бензоле
|
|
|
|
Химические свойства
Бензольное ядро обладает высокой прочностью, чем и объясняется склонность ароматических углеводородов к реакциям замещения. В отличие от алканов, которые также склонны к реакциям замещения, ароматические углеводороды характеризуются большой подвижностью атомов водорода в ядре, поэтому реакции галогенирования, нитрования, сульфирования и др. протекают в значительно более мягких условиях, чем у алканов.
Несмотря на то, что бензол по составу является ненасыщенным соединением, для него не характерны реакции присоединения. Типичными реакциями бензольного кольца являются реакции замещения атомов водорода – точнее говоря, реакции электрофильного замещения.
Рассмотрим примеры наиболее характерных реакций этого типа.
1) Галогенирование. При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода ядра замещается галогеном.
 + Cl2 –AlCl3®
+ Cl2 –AlCl3® 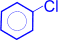 (хлорбензол) + H2O
(хлорбензол) + H2O
Реакции галогенирования осуществляются в присутствии катализатора, в качестве которого чаще всего используют хлориды алюминия или железа.
2) Нитрование. При действии на бензол нитрующей смеси атом водорода замещается нитрогруппой (нитрующая смесь – это смесь концентрированных азотной и серной кислот в соотношении 1:2 соответственно).
 + HNO3 –H2SO4®
+ HNO3 –H2SO4®  (нитробензол) + H2O
(нитробензол) + H2O
Серная кислота в данной реакции играет роль катализатора и водоотнимающего средства.
3) Сульфирование. Реакция сульфирования осуществляется концентрированной серной кислотой или олеумом (олеум – это раствор серного ангидрида в безводной серной кислоте). В процессе реакции водородный атом замещается сульфогруппой, приводя к моносульфокислоте.
 + H2SO4 –SO3®
+ H2SO4 –SO3®  (бензолсульфокислота) + H2O
(бензолсульфокислота) + H2O
4) Алкилирование (реакция Фриделя-Крафтса). При действии на бензол алкилгалогенидов в присутствии катализатора (хлористого алюминия) осуществляется замещение алкилом атома водорода бензольного ядра.
 + R–Cl –AlCl3®
+ R–Cl –AlCl3®  (R-углеводородный радикал) + HCl
(R-углеводородный радикал) + HCl
Следует отметить, что реакция алкилирования представляет собой общий способ получения гомологов бензола - алкилбензолов.
Рассмотрим механизм реакции электрофильного замещения в ряду бензола на примере реакции хлорирования.
Первичной стадией является генерирование электрофильной частицы. Она образуется в результате гетеролитического расщепления ковалентной связи в молекуле галогена под действием катализатора и представляет собой хлорид-катион.
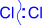
| + AlCl3 ® Cl+ + AlCl4- |
Образующаяся электрофильная частица атакует бензольное ядро, приводя к быстрому образованию нестойкого p- комплекса, в котором электрофильная частица притягивается к электронному облаку бензольного кольца.

| + Cl+ ® | 
| Cl+ |
| p- комплекс |
Иными словами, p- комплекс – это простое электростатическое взаимодействие электрофила и p- электронного облака ароматического ядра.
Далее происходит переход p- комплекса в s- комплекс, образование которого является наиболее важной стадией реакции. Электрофильная частица "захватывает" два электрона s- электронного секстета и образует s- связь с одним из атомов углерода бензольного кольца.

| Cl+ ® | 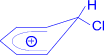 s- комплекс
s- комплекс
|
s- Комплекс – это катион, лишенный ароматической структуры, с четырьмя p- электронами, делокализованными (иначе говоря, распределенными) в сфере воздействия ядер пяти углеродных атомов. Шестой атом углерода меняет гибридное состояние своей электронной оболочки от sp2- до sp3-, выходит из плоскости кольца и приобретает тетраэдрическую симметрию. Оба заместителя – атомы водорода и хлора располагаются в плоскости, перпендикулярной к плоскости кольца.
На заключительной стадии реакции происходит отщепление протона от s- комплекса и ароматическая система восстанавливается, поскольку недостающая до ароматического секстета пара электронов возвращается в бензольное ядро.
 ®
®  + H+
+ H+
Отщепляющийся протон связывается с анионом четыреххлористого алюминия с образованием хлористого водорода и регенерацией хлорида алюминия.
H+ + AlCl4- ® HCl + AlCl3
Именно благодаря такой регенерации хлорида алюминия для начала реакции неоходимо очень небольшое (каталитическое) его количество.
Несмотря на склонность бензола к реакциям замещения, он в жестких условиях вступает и в реакции присоединения.
1) Гидрирование. Присоединение водорода осуществляется только в присутствии катализаторов и при повышенной температуре. Бензол гидрируется с образованием циклогексана, а производные бензола дают производные циклогексана.
 + 3H2 –t°,p,Ni®
+ 3H2 –t°,p,Ni®  (циклогексан)
(циклогексан)
2) На солнечном свету под воздействием ультрафиолетового излучения бензол присоединяет хлор и бром с образованием гексагалогенидов, которые при нагревании теряют три молекулы галогеноводорода и приводят к тригалогенбензолам.

| + 3Cl2 –hn® | 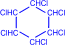 гексахлорциклогексан
гексахлорциклогексан
| 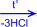
| 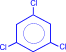 сим-трихлорбензол
сим-трихлорбензол
|
3) Окисление. Бензольное ядро более устойчиво к окислению, чем алканы. Даже перманганат калия, азотная кислота, пероксид водорода в обычных условиях на бензол не действуют. При действии же окислителей на гомологи бензола ближайший к ядру атом углерода боковой цепи окисляется до карбоксильной группы и дает ароматическую кислоту.
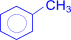 + 2KMnO4 ®
+ 2KMnO4 ® 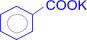 (калиевая соль бензойной кислоты) + 2MnO2 + KOH + H2O
(калиевая соль бензойной кислоты) + 2MnO2 + KOH + H2O
 + 4KMnO4 ®
+ 4KMnO4 ®  + K2CO3 + 4MnO2 + 2H2O + KOH
+ K2CO3 + 4MnO2 + 2H2O + KOH
Во всех случаях, как видно, независимо от длины боковой цепи образуется бензойная кислота.
При наличии в бензольном кольце нескольких заместителей можно окислить последовательно все имеющиеся цепи. Эта реакция применяется для установления строения ароматических углеводородов.
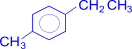 –[O]®
–[O]® 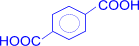 (терефталевая кислота)
(терефталевая кислота)
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1595; Нарушение авторских прав?; Мы поможем в написании вашей работы!