
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Простейший альдегид – муравьиный – газ с весьма резким запахом
|
|
|
|
Физические свойства
Простейший альдегид – муравьиный – газ с весьма резким запахом. Другие низшие альдегиды – жидкости, хорошо растворимые в воде. Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в альдегидах водородных связей. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Физические свойства некоторых альдегидов представлены в таблице.
Таблица. Физические свойства некоторых альдегидов
| Название | Формула | t°кип., °C | t°пл., °C | d420 |
| Муравьиный альдегид | O II H–C I H | -92,0 | -21,0 | 0,815 (при 20°С) |
| Уксусный альдегид | O II CH3–C I H | -123,5 | 21,0 | 0,780 |
| Пропионовый альдегид | O II CH3–CH2–C I H | -102,0 | 48,8 | 0,807 |
| Масляный альдегид | O II CH3–CH2–CH2–C I H | -99,0 | 75,7 | 0,817 |
| Изомасляный альдегид | O II CH3–CH–C I I CH3 H | -65,9 | 64,0 | 0,794 |
Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы. Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три s- связи (одна из них – связь С–О), которые расположены в одной плоскости под углом 120° друг к другу.
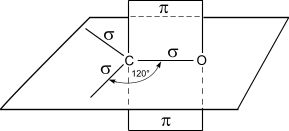
Схема строения карбонильной группы
Двойная связь карбонильной группы по физической природе сходна с двойной связью между углеродными атомами, т. е. это сочетание s- и p- связей, последняя из которых образована р- электронами атомов углерода и кислорода. Ввиду большей электроотрицательности атома кислорода по сравнению с атомом углерода, связь С=О сильно поляризована за счет смещения электронной плотности p- связи к атому кислорода, в результате чего на атоме кислорода возникает частичный отрицательный (d-), а на атоме углерода – частичный положительный (d+) заряды: 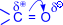 .
.
Благодаря поляризации атом углерода карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Важнейшими реакциями альдегидов являются реакции нуклеофильного присоединения по двойной связи карбонильной группы.
1. Одной из типичных реакций нуклеофильного присоединения альдегидов является присоединение синильной (циановодородной) кислоты, приводящее к образованию a- оксинитрилов.
| CH3– | 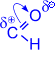
| +
| OH I ––KCN® CH3–C–CN I H | |
Эта реакция используется для удлинения углеродной цепи и получения a- оксикислот.
2. Присоединение гидросульфита натрия дает кристаллические вещества, обычно называемые гидросульфитными производными альдегидов.
| O II CH3–C I H | + HSO3Na ® CH3– | OH I C–SO3Na (гидросульфитное производное уксусного альдегида) I H |
Упомянутые производные легко гидролизуются в любых средах, приводя к исходному карбонильному соединению. Так, при нагревании с раствором соды гидросульфитного производного уксусного альдегида образуется собственно уксусный альдегид.
| 2CH3– | OH I C–SO3Na + Na2CO3 ® 2CH3– I H | O II C + 2Na2SO3 + CO2 + H2O I H |
Данное свойство используется для очистки альдегидов и выделения их из смесей.
3. Присоединение спиртов к альдегидам приводит к образованию полуацеталей – соединений, в которых атом углерода связан и с гидроксильной (–ОН), и с алкоксильной (–ОR) группами.
| R– | 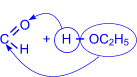
| OH I «R–CH I OC2H5 (полуацеталь) |
При обработке полуацеталей избытком спирта в кислой среде образуются ацетали – соединения, в которых атом углерода связан с двумя алкоксильными группами (реакция напоминает синтез простых эфиров из спиртов).
| R– | 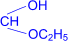 полуацеталь полуацеталь
| + H–OC2H5 | ¬H+® | R– | 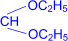 ацеталь ацеталь
| + H2O |
В отличие от простых эфиров ацетали гидролизуются под действием кислот с образованием спирта и альдегида.
4. Присоединение водорода к альдегидам осуществляется в присутствии катализаторов (Ni, Co, Pd и др.) и приводит к образованию первичных спиртов.
| O II R–C + H2 ––Ni® R–CH2–OH(первичный спирт) I H |
Все чаще в качестве восстанавливающего агента применяют алюмогидрид лития LiAlH4 и борогидрид натрия NaBH4.
Помимо реакций присоединения по карбонильной группе для альдегидов характерны также реакции окисления.
5. Окисление. Альдегиды легко окисляются, образуя соответствующие карбоновые кислоты.
| O II R–C I H | ––[O]® | O II R–C (кислота) I OH |
a) аммиачный раствор оксида серебра [Ag(NH3)2]OH при нагревании с альдегидами окисляет альдегид до кислоты (в виде ее аммониевой соли) с образованием свободного металлического серебра. Восстановленное серебро ложится тонким слоем на стенки химического сосуда, в котором осуществляется реакция, и получается серебряное зеркало. Эта реакция, получившая поэтому название "серебряного зеркала", служит качественной реакцией на альдегиды.
| O II CH3–C+ 2[Ag(NH3)2OH ––t°® CH3COONH4(ацетат аммония) + 2Ag¯ + 3NH3 + H2O I H |
b) еще одной характерной реакцией является окисление альдегидов гидроксидом меди (II).
| O II CH3–C I H | + 2Cu(OH)2(голубой) ––t°® CH3– | O II C (уксусная к-та) + Cu2O¯(красный) +2H2O I OH |
При нагревании голубого гидроксида меди (II) с раствором уксусного альдегида выпадает красный осадок оксида меди (I). При этом уксусный альдегид окисляется до уксусной кислоты, а медь со степенью окисления +2 восстанавливается до меди со степенью окисления +1. Муравьиный альдегид (формальдегид) занимает особое место в ряду альдегидов. В связи с отсутствием у муравьиного альдегида радикала, ему присущи некоторые специфические свойства. Окисление формальдегида, например, осуществляется до двуокиси углерода СО2.
Формальдегид легко полимеризуется с образованием циклических и линейных полимеров. Так, в кислой среде он образует циклический тример – триоксиметилен.

| =O | H+ –® | 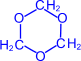 (триоксиметилен) (триоксиметилен)
|
Сухой газообразный формальдегид в присутствии катализаторов образует высокомолекулярный полиформальдегид. Полимеризация формальдегида напоминает полимеризацию алкенов.

| =O + | 
| =O ––kat® | H I …–C I H | H I –O–C–O–… I H | 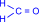 –––––® –––––®
| …–H2C–O |
В водных растворах формальдегид образует полимер, называемый параформом.
n CH2 = O + H2O ® HOCH2(OCH2)n-2OCH2OH
(параформ)
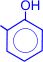
Особое практическое значение имеет реакция поликонденсации формальдегида с фенолом с образованием фенолформальдегидных смол. При действии щелочных или кислых катализаторов на смесь фенола и формальдегида конденсация идет в орто- и пара- положениях.
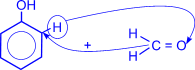
| H+ или OH- | 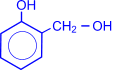
|
| –––––––––––––® |
Рост молекулы за счет конденсации фенола с формальдегидом осуществляется при нормальной температуре в линейном направлении.
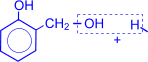
| 
| ® H2O + | 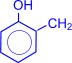
| 
|

|  
| ® | 
| 
| CH2OH / |
и т. д.
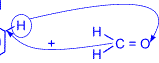
Суммарно реакцию поликонденсации фенола с формальдегидом можно изобразить следующим образом:
| n | 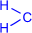
| = O + (n+1) | 
| катализатор | 
| 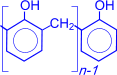
| + nH2O |
| ––––––––® |
Фенолформальдегидные смолы – первенцы промышленных синтетических смол, их производство под названием "бакелит" впервые начато в 1909 году. Фенолформальдегидные смолы используются в производстве различных пластмасс. В сочетании с различными наполнителями такие пластмассы называются фенопластами. Кроме того, фенолформальдегидные смолы применяются при изготовлении различных клеев и лаков, термоизоляционных материалов, древесных пластиков, литейных форм и др.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1210; Нарушение авторских прав?; Мы поможем в написании вашей работы!