
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы титрования
|
|
|
|
Различают три основных способа титрования: прямое, обратное, косвенное или заместительное.
При прямом титровании используют исследуемый и один рабочий растворы. В процессе определения к определённому точно измеренному объёму одного из них по каплям добавляют второй раствор до наступления точки эквивалентности.
Закон эквивалентов в этом случае может быть математически записан следующим образом:
N1V1 = N2V2
где V1 и V2 – объёмы израсходованных исследуемого и рабочего растворов, соответственно; N1 и N2- молярные концентрации химических эквивалентов веществ исследуемого и рабочего растворов, соответственно.
Молярную концентрацию химического эквивалента вещества в исследуемом растворе рассчитывают по формуле:
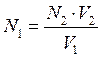 .
.
При обратном титровании используют исследуемый и два рабочих раствора, один их которых является вспомогательным, а второй применяют для титрования.
В процессе анализа к определённому точно измеренному объёму исследуемого раствора одномоментно добавляют взятый в избытке фиксированный объём вспомогательного рабочего раствора. В результате протекания химической реакции вещество, присутствующее в исследуемом растворе, расходуется полностью. Не прореагировавший избыток вещества вспомогательного раствора титруется затем вторым рабочим раствором до наступления точки эквивалентности, например:
К2SO3 + I2 + H2O → K2SO4 + 2HI
Исследуемый Вспомогательный
раствор рабочий раствор
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Второй рабочий
раствор
Таким образом, вещество, присутствующее во вспомогательном рабочем растворе, реагирует как с веществом исследуемого раствора, так и с веществом второго рабочего раствора. Закон эквивалентов в этом случае математически может быть записан следующим образом:
N2V2 = N1V1 + N3V3
где V1, V2, V3 – израсходованные объёмы исследуемого, вспомогательного и второго рабочих растворов, соответственно; N1, N2, N3 – молярные концентрации химических эквивалентов веществ в исследуемом, вспомогательном и во втором рабочих растворах, соответственно.
Молярную концентрацию химического эквивалента рассчитывают по формуле:
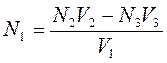
Обратное титрование в аналитической практике может называться иначе титрованием по остатку или с двумя титрантами.
Оно используется, если определяемое вещество не реагирует или реагируют медленно с веществом второго рабочего раствора, либо в реакции между ними невозможно определить точку эквивалентности.
При косвенном, или заместительном, титровании также используют исследуемый раствор и два рабочих раствора. В ходе анализа к точно измеренному объёму исследуемого раствора одномоментно добавляют нефиксированный заведомый избыток первого рабочего раствора. В результате протекающей реакции вещество исследуемого раствора полностью расходуется с образованием эквивалентного количества соответствующего продукта реакции, который затем титруется вторым рабочим раствором до наступления точки эквивалентности, например:
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
исследуемый первый рабочий эквивалентное
раствор раствор кол-во продукта реакции
2Na2S2O3 + I2 = 2NaI + Na2S4O6
второй рабочий
раствор
Таким образом, мы как бы замещаем определяемое вещество на другое, которое впоследствии и подвергаем анализу.
Так как количество вещества эквивалента образовавшегося продукта и количество вещества эквивалента в исследуемом растворе равны между собой, то молярную концентрацию химического эквивалента вещества в исследуемом растворе рассчитываем по такой же формуле, как и при прямом титровании.
Заместительное титрование применяют, когда непосредственное определение вещества в исследуемом растворе невозможно: отсутствует подходящий титрант, нельзя установить точку эквивалентности и т.п.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1396; Нарушение авторских прав?; Мы поможем в написании вашей работы!