
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 1 административное право как отрасль права
|
|
|
|
Содержание
Рис. 128. Типичная хроматограмма смеси, состоящей из трех веществ, полученная методом ГЖХ
К основным хроматографическим параметрам, характеризующим поведение веществ в колонке, относятся: время удерживания (tR) и удерживаемый объем (VR).
Время удерживания – это время от момента ввода анализируемой пробы до регистрации максимума пика (рис. 128).
Удерживаемый объем – это объем подвижной фазы, который нужно пропускать через колонку с определенной скоростью, чтобы полностью элюировать вещество.
При постоянных условиях хроматографирования время удерживания и удерживаемый объем строго воспроизводимы и могут быть использованы для идентификации веществ.
Площадь пика на хроматограмме позволяет судить о количественном присутствии того или иного вещества в смеси.
Для идентификации веществ на тонкослойной хроматограмме используется степень или коэффициент разделения Rf, представляющий собой отношение пути l x, пройденного веществом к пути, пройденному растворителем l 0 (рис. 129):
Rf = l x/ l 0
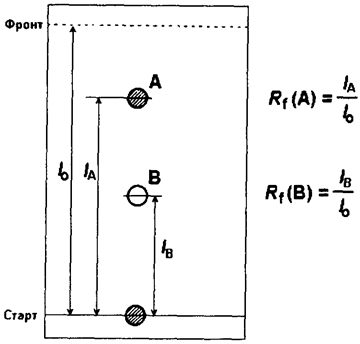
Рис. 129. Тонкослойная хроматография. Анализируемую смесь (А + В) наносят на линию старта, подвижная фаза перемещается от линии старта к линии фронта. При правильном подборе адсорбента и растворителя компоненты образуют отдельные зоны (А и В)
Зоны разделенных веществ в тонкослойной хроматографии часто выявляют с помощью специальных веществ, которые образуют с разделяемыми компонентами смеси окрашенные соединения, проявляемые на неподвижной фазе в виде цветных пятен. Например, при разделении смеси аминокислот неподвижную фазу после проведения анализа обрабатывают раствором нингидрина. При этом на ней образуются области окрашивания, расположенные на разных расстояниях от линии старта в зависимости от адсорбционной способности той или иной аминокислоты (рис. 129).
В настоящее время хроматография является широко используемым, высокочувствительным, универсальным и экспрессным методом, позволяющим определить как качественный, так и количественный состав самых различных смесей веществ.
Особенно широко она применяется в биологических исследованиях для выделения из биологических жидкостей липидов, полисахаридов, белков, нуклеиновых кислот, ферментов, аминокислот и других биологически активных соединений.
Хроматография широко применяется не только в медико-биологических исследованиях, но и в клинической практике. Анализ крови на присутствие в ней алкоголя, наркотиков, летучих веществ, вызывающих токсикоманию, проводят с помощью хроматографии за считанные минуты. Хроматография является незаменимым методом для допинг-контроля, т.е. обнаружения стимулирующих веществ в организме спортсменов. С помощью хроматографии можно выявить микрокомпоненты (не определяемые другими методами), которые появляются в биологических жидкостях при наличии той или иной патологии.
С каждым годом значение хроматографии, как важного диагностического метода, постоянно возрастает.
Применение закона действующих масс к растворам электролитов 3
Электролитическая диссоциация. 4
Электролиты и неэлектролиты. Теория электролитической диссоциации 4
Общая характеристика электролитов. 7
Слабые электролиты.. 9
Сильные электролиты.. 14
Теория кислот и оснований. Буферные растворы.. 20
Теория кислот и оснований. 20
Буферные растворы.. 31
Определение буферных систем и их классификация. 31
Механизм действия буферных систем.. 35
Вычисление рН и рОН буферных систем. Уравнение Гендерсона-Гассельбаха 37
Буферная емкость. 42
Гетерогенные равновесия. 46
Константа растворимости.
Правило растворимости осадков. 46
Образование и растворение осадков. 51
Однотипные и разнотипные конкурирующие равновесия в гетерогенных системах. 57
Определение комплексных соединений и их общая характеристика 60
Строение комплексных соединений. 62
Классификация комплексных соединений. 67
Диссоциация комплексных соединений. 70
ГИДРОЛИЗ СОЛЕЙ.. 74
Количественный анализ. 80
ОСНОВЫ ТИТРИМЕТРИЧЕСКОГО МЕТОДА АНАЛИЗА.. 81
Химический эквивалент.. 81
Молярная масса эквивалентов вещества. 85
Химическое количество эквивалентов вещества. 86
Молярная концентрация эквивалентов вещества. 86
Закон эквивалентов. 87
Титриметрический анализ. 88
Общая характеристика метода. 88
Требования, предъявляемые к реакциям, которые используют в титриметрии. 93
Способы титрования. 94
Способы приготовления рабочих растворов. 96
Правила работы с мерной посудой при проведении аналитических измерений. 98
Проведение титрования. 107
Кислотно-основное титрование. 108
Общая характеристика метода. 108
Определение точки эквивалентности в кислотно-основном титровании. Кислотно-основные индикаторы.. 110
Подбор индикаторов при кислотно-основном титровании. 114
Кривые титрования многоосновных (полипротонных) кислот, многокислотных оснований и их солей. 120
Применение кислотно-основного титрования. 123
Редоксиметрия. 125
Общая характеристика и классификация методов. 125
Кривые титрования в редоксиметрии. 127
Способы определения точки эквивалентности. 128
Перманганатометрия. 130
Иодометрия. 133
Физико-химические методы анализа. 138
Практическое применение электропроводности. 138
Потенциометрия. 140
Хроматография. 143
Общая характеристика метода. 143
Классификация хроматографических методов анализа. 146
Методика разделения и идентификации компонентов
смеси. 149
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 346; Нарушение авторских прав?; Мы поможем в написании вашей работы!