
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотность и основность
|
|
|
|
Классификация органических реакций
Химические реакции – это процессы, сопровождающиеся изменением распределения электронов внешних оболочек атомов реагирующих веществ. В ходе реакции в молекулах реагирующих веществ разрываются одни химические связи и образуются другие. Реакция идет в сторону образования стабильных частиц, т.е. обладающих меньшей внутренней энергией.
Классифицировать реакции можно по различным признакам.
А. По типу разрыва химических связей в реагирующих частицах (субстрат и реагент). Субстрат – это реагирующее вещество, реагент – действующее вещество. Но это разделение условное.
Различают три типа реагентов:
1) радикалы (R) – это нейтральные атомы или частицы с неспаренным электроном (Н×, С1×, ×ОН, ×СН3 и др.);
2) нуклеофилы (Nu – «любящие ядра») – это частица, имеющая электронную пару на внешнем электронном уровне атома (Н–, НО–, Наl–, Н2О:,:NН3, СН2=СН2, С6Н6 и др.);
3) элекрофилы (Е – «любящие электроны») – это частицы, имеющие недостаток электронов – незаполненный валентный электронный уровень (катионы Н+, NО2+, молекулы А1С13, SО3 и др.).
В реакциях нуклеофил атакует в субстрате реакционный центр с недостатком электронов, электрофил атакует реакционный центр с избытком электронов. Соответственно этому различают:
I. Радикальные реакции
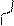
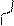 Н3С: Н + С1: С1
Н3С: Н + С1: С1  СН3С1 + НС1
СН3С1 + НС1
Субстрат(S) Реагент
II. Электрофильные реакции

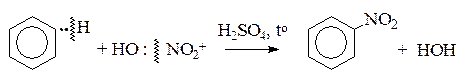
Nu (S) Е (реагент)
III. Нуклеофильные реакции
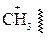 |  |
: С1- + Nа+: ОН- ® СН3ОН + NаС1
Б. По количеству и характеру исходных и конечных продуктов различают типы реакций:
1. Реакции замещения (S)
СН3С1 + NаОН ® СН3ОН + NаС1
Е Nu
Они подобны реакциям обмена в неорганической химии.
2. Реакции присоединения (А)
СН2 = СН2 + Br2 ® СН2Br - СН2Br
3. 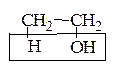
 Реакции отщепления (элиминирования) – это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними
Реакции отщепления (элиминирования) – это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними
p-связи.
СН2 = СН2 + НОН
4. Реакции перегруппировки
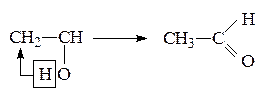
(Правило А. Эльтекова)
С учетом характера реагентов реакции замещения и присоединения могут быть нуклеофильными, электрофильными и радикальными и обозначаются следующим образом:
1)  Реакции нуклеофильного замещения (SN)
Реакции нуклеофильного замещения (SN)
– С1- + Nа+ – ОН- ® СН3ОН + NаС1
E Nu
2) Реакции электрофильного замещения (SЕ)
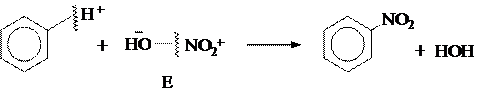 |
3) Реакции радикального замещения (SR)
 Н3С: Н + С1: С1
Н3С: Н + С1: С1 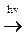 СН3С1 + НС1
СН3С1 + НС1
4) Реакции электрофильного присоединения (АЕ)
Н2С = СН2 + Н+С1– ® СН3 – СН2С1
5) 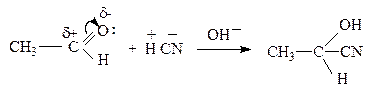 Реакции нуклеофильного присоединения (АN)
Реакции нуклеофильного присоединения (АN)
ЛЕКЦИЯ 3
Для характеристики кислотности и основности органических соединений применяют теорию Бренстеда. Основные положения этой теории:
1) Кислота – это частица, отдающая протон (донор Н+); основание – это частица, принимающая протон (акцептор Н+).
2) Кислотность всегда характеризуется в присутствии оснований и наоборот.
Примеры:
А – Н +: В Û А– + В – Н+
К-та Осн-ие Сопряженное Сопряженная
осн-ие к-та
СН3СООН + НОН Û СН3СОО– + Н3О+
К-та Осн-ие Сопряженное Сопряженная
осн-ие к-та
НNО3 + СН3СООH Û СН3СООН2+ + NО3-
К-та Осн-ие Сопряженная Сопряженное
к-та осн-ие
Кислоты Бренстеда
3) К-ты Бренстеда делятся на 4 вида в зависимости от кислотного центра:
 - SН к-ты (тиолы),
- SН к-ты (тиолы),
- ОН к-ты (спирты, фенолы, карбоновые к-ты),
- NН к-ты (амины, амиды),
- СН к-ты (УВ).
В этом ряду сверху вниз кислотность уменьшается.
4) Сила к-ты определяется стабильностью образующегося аниона. Чем стабильнее анион, тем сильнее к-та. Стабильность аниона зависит от делокализации (распределения) «-» заряда по всей частице (аниону). Чем больше делокализован «-» заряд, тем стабильнее анион и сильнее к-та.
Делокализация заряда зависит:
a) от электроотрицательности (ЭО) гетероатома. Чем больше ЭО гетероатома, тем сильнее соответствующая к-та.
Например: R – ОН и R – NН2
Спирты более сильные к-ты, чем амины, т.к. ЭО (О) > ЭО (N).
б) от поляризуемости гетероатома. Чем больше поляризуемость гетероатома, тем сильнее соответствующая к-та.
Например: R – SН и R – ОН
Тиолы более сильные к-ты, чем спирты, т.к. атом S более поляризован, чем атом О.
в) от характера заместителя R (длины его, наличие сопряженной системы, делокализации электронной плотности).
Например: СН3 – ОН, СН3 – СН2 – ОН, СН3 – СН2 – СН2 – ОН
 Кислотность <, т.к. увеличивается длина радикала
Кислотность <, т.к. увеличивается длина радикала
 При одинаковом кислотном центре сила спиртов, фенолов и карбоновых к-т не одинакова. Например,
При одинаковом кислотном центре сила спиртов, фенолов и карбоновых к-т не одинакова. Например,
СН3 – ОН, С6Н5 – ОН,

Сила к-ты увеличивается
Фенолы являются более сильными к-тами, чем спирты за счет р, p-сопряжения (+М) группы –ОН.
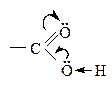 Связь О–Н более поляризуется в фенолах. Фенолы могут взаимодействовать даже с солями (FеС13) – качественная реакция на фенолы. Карбоновые
Связь О–Н более поляризуется в фенолах. Фенолы могут взаимодействовать даже с солями (FеС13) – качественная реакция на фенолы. Карбоновые
к-ты по сравнению со спиртами, содержащими одинаковый R, являются более сильными к-тами, т.к. связь О–Н значительно поляризована за счет –М эффекта группы > С = О:
Кроме того карбоксилат-анион более стабилен, чем анион спирта за счет р,p-сопряжения в карбоксильной группе.
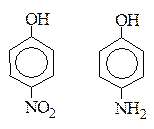 г) от введения заместителей в радикал. ЭА заместители увеличивают кислотность, ЭД заместители уменьшают кислотность.
г) от введения заместителей в радикал. ЭА заместители увеличивают кислотность, ЭД заместители уменьшают кислотность.
Например:
р-Нитрофенол более сильная к-та, чем р-аминофенол, т.к. группа –NО2 является ЭА.
СН3–СООН ССl3–СООН
рК 4,7 рК 0,65
Трихлоруксусная к-та во много раз сильнее СН3СООН за счет – I атомов Сl как ЭА.
Муравьиная к-та Н–СООН сильнее СН3СООН за счет +I группы СН3– уксусной к-ты.
д) от характера растворителя.
Если растворитель является хорошим акцептором протонов Н+, то сила
к-ты увеличивается и наоборот.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1090; Нарушение авторских прав?; Мы поможем в написании вашей работы!