КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аминоспирты
|
|
|
|
ОН
ОН ОН
|
|
3, 5-Дибромсалициловая к-та
При бромировании, нитрировании, сульфировании салициловой к-ты заместители поступают в орто- и пара- положения по отношению к –ОН группе и в мета- положение по отношению –СООН гр., т.о. действие двух функциональных групп согласованное.
Оксокислоты
Это карбоновые к-ты, содержащие карбонильную группу. Различают кето- и альдегидок-ты.
Номенклатура
Тривиальная, рациональная, международная:
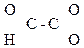 СН3–
СН3–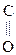 –СООН СН3–
–СООН СН3–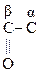 Н2–СООН
Н2–СООН
Глиоксалевая Пировиноградная Ацетоуксусная к-та (АУК),
к-та к-та (ПВК), b-кетомасляная к-та,
a-кетопропионовая, 3-оксобутановая к-та
2-оксопропановая
к-та
Изомерия кеток-т – это изомерия цепи и положения гр. 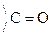 .
.
Оксок-ты могут быть одно-, двух- и многоосновные.
НООС–(СН2)2– –СООН, НООС–СН2–
–СООН, НООС–СН2– –СООН
–СООН
a-Кетоглутаровая к-та Щавелевоуксусная к-та (ЩУК),
2-кетоянтарная к-та
Все указанные к-ты являются естественными продуктами обмена веществ.
Оксок-ты, имея в молекуле гр. –СООН и 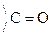 , обладают св-вами, характерными для к-т, альдегидов и кетонов.
, обладают св-вами, характерными для к-т, альдегидов и кетонов.
Р-ции по гр. –СООН – смотрите р-ции в разделе оксик-т; оксок-ты диссоциируют, образуют соли, сложные эфиры, ангидриды, хлорангидриды, амиды.
По карбонильной гр. идут р-ции АN, при этом образуются оксимы, гидразоны, оксинитрилы и т.д., т.е. проходят р-ции с Н2, РС15, NH2OH, NH2– NH2, NH2–NH–С6Н5, НСN, НОR, р-ции окисления.
|
|
|
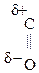 –СООН
–СООН 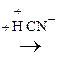
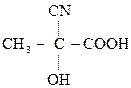 ,
,
|
|
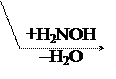
В этом случае р-ции протекают легче, чем для обычных кетонов.
2-оксо-ты окисляются даже такими слабыми окислителями как Сu(ОН)2, при этом образуются две к-ты как и для типичных кетонов:
Н2О + СО2
|
|
 –СООН + О + НОН ® СН3СООН + НО–СООН
–СООН + О + НОН ® СН3СООН + НО–СООН
Пировиноградная к-та
Это результат увеличения d+ заряда атома С гр. 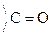 и объясняет также способность кеток-т легко декарбоксилироваться. Пировиноградная к-та при нагревании или действии фермента декарбоксилазы разлагается:
и объясняет также способность кеток-т легко декарбоксилироваться. Пировиноградная к-та при нагревании или действии фермента декарбоксилазы разлагается:
|
 –СООН ® СН3–
–СООН ® СН3–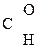 + СО2
+ СО2
Ацетоуксусная к-та легко декарбоксилируется как и все b-кеток-ты даже при слабом нагревании:
СН3– –СН2–СООН
–СН2–СООН 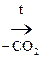 СН3–
СН3– –СН3
–СН3
АУК Ацетон
В свою очередь 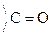 группа, оказывая влияние на гр. –СООН, увеличивает ее кислотность. ПВК в 500 раз сильнее пропионовой к-ты.
группа, оказывая влияние на гр. –СООН, увеличивает ее кислотность. ПВК в 500 раз сильнее пропионовой к-ты.
Для оксок-т характерно существование двух изомерных форм: кетонной и енольной, легко переходящих друг в друга и находящихся в динамическом равновесии. Напомним, что явление существования вещ-ва в виде нескольких изомерных формах, легко переходящих друг в друга и находящихся в подвижном равновесии, наз-ся таутомерией. В зависимости от возникающих групп таутомерия наз-ся по-разному: кето-енольная, лактим-лактаимная, прототропная. Для кеток-т характерна кето-енольная таутомерия:
|
|
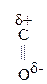
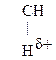 –
–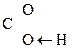 Û R–
Û R– =CH–
=CH–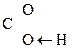 .
.
Кето-енольная таутомерия встречается и в обычных альдегидах и кетонах, однако енола содержится в таких системах очень мало (~ 2,5 ×10-5%), т.е. равновесие практически сдвинуто в сторону кетонной формы:
СН3– –СН3 ¬ СН3–
–СН3 ¬ СН3–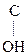 =CH2
=CH2
Ацетон
Введение ЭА заместителя у енолизированного атома С, например гр. –СООН, смещает равновесие в сторону енола:
|
|
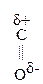 –
–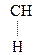 –
–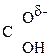 Û СН3–
Û СН3–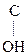 =CH–СООН
=CH–СООН
Енольная форма стабилизируется, если двойная С=С связь сопряжена со второй p-системой или гр. –ОН участвует в образовании внутримолекулярной Н-связи. Так, этиловый эфир ацетоуксусной к-ты существует уже на 7,5% в енольной форме, т.к. стабилизирован Н-связью:
СН3–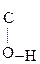 СН–
СН– –ОС2Н5 Û СН3–
–ОС2Н5 Û СН3– –CH2–
–CH2–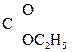 .
.
Смещение равновесия зависит от природы растворителя, температуры (с ее увеличением уменьшается содержание енольной формы) и др. факторов.
Доказательством наличия енольной формы являются р-ции: с Вr2 (водой) – на двойную связь (обесцвечивание), с FeC13 р-ция на –ОН гр. (фиолетовое окрашивание); наличие 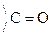 гр. – р-ции с NH2OH, NH2– NH2, NH2–NH–С6Н5 (образование осадков).
гр. – р-ции с NH2OH, NH2– NH2, NH2–NH–С6Н5 (образование осадков).
Многие р-ции в живых организмах проходят через енольную форму. Так, фосфорный эфир пировиноградной к-ты является важным фосфолирующим и ацилирующим агентом обмена вещ-в:
CH2=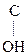 –
–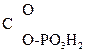 .
.
ЛЕКЦИЯ 8
Аминофенолы (АФ)
Это соединения, содержащие две функциональные гр. –ОН и –NН2 в положениях: о-, м-, п-.
Получают нитрированием фенола и образовавшийся нитрофенол восстанавливают до аминофенола.

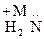 – –
– –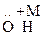
n-Аминофенол
Две функциональные гр. увеличивают электронную плотность бензольного кольца, следовательно, увеличивается его реакционная способность в р-циях SЕ.
Электронная плотность гр. –NН2 и –ОН понижаются, что уменьшает кислотность –ОН гр. и увеличивает основность гр. – NН2 по сравнению с анилином. АФ – амфотерное соединение, образующее соли и с к-тами, и со щелочами. Как дифункциональное соединение АФ образует производные по каждой функциональной гр. и по обеим гр.:
ОС2Н5 ОС2Н5
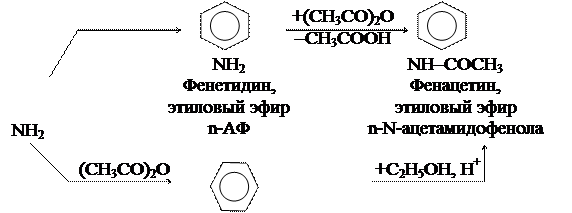 +С2Н5ОН, Н+
+С2Н5ОН, Н+
 |
НО– –NH–COCH3
Парацетамол,
n-N-ацетамидофенол
Парацетамол и фенацетин оказывают анальгетическое и жаропонижающее действие.
(Соldех содержит парацетамол + кофеин + терпингидрат).
Химические свойства:
 |
 диссоциация Û Н+ + –О– –NH2,
диссоциация Û Н+ + –О– –NH2,
+ NаОН ® Соль,
+СН3СОС1 ® Сложный эфир,
+ FеС13 ® Фиолетовое окрашивание,
+ СН3I ® Вторичные и третичные амины,
 + НNО2 ® Гидрохинон,
+ НNО2 ® Гидрохинон,
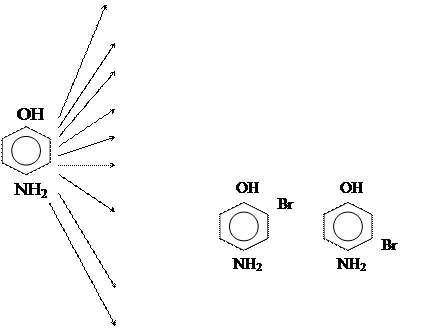
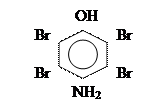
+ 3Вr2 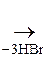 + +
+ +
+ НОNО2 ® Продукты нитрования,
+ НОSO3H ® Продукты сульфирования
По бензольному кольцу легко идут р-ции SЕ – бромирования, нитрования и сульфирования. Т.к. действие заместителей несогласованно, то замещение может проходить в любом или даже во всех четырех положениях.
Важное значение в медицине играет n-аминосалициловая к-та (ПАСК) – противотуберкулезное средство. Лечебный эффект объясняется тем, что она является антагонистом n-аминобензойной к-ты (ПАБК) – структурный аналог – необходимый для нормальной жизнедеятельности микроорганизмов. Другие изомеры таким действием не обладают.
СООН СООН

 ОН
ОН
NН2 NН2
n-Аминосалициловая n-Аминобензойная
к-та к-та
Это производные УВ, содержащие гр. –NН2 и –ОН. Первый член гомологического ряда
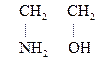
2-Аминоэтанол-1,
моноэтаноламин,
коламин
Коламин входит в состав сложных липидов. Производное коламина – димедрол – обладает противоаллергическим и слабым снотворным действием.
Коламин по гр. –NН2 проявляет св-ва аминов. Дает те же р-ции, что и аминофенолы: с НС1, СН3ОН, СН3СОС1, НNО2, НОН:
НО–(СН2)2– Н2 +
Н2 +  Н ® [НО–(СН2)2–NН3+]ОН–.
Н ® [НО–(СН2)2–NН3+]ОН–.
В р-ции алкилирования коламин образует метилированное производное по типу четвртичного аммониевого основания – холин – триметилоксиэтилгидроксид аммония:
[НО–СН2– СН2–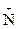 Н3]ОН– + 3СН3I
Н3]ОН– + 3СН3I 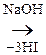
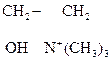 ОН–.
ОН–.
Холин
(В организме донором метильных групп является аминок-та метионин СН3–S– СН2– СН2–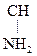 –СООН).
–СООН).
Р-ции, протекающие по –ОН гр: с Ме, РС15, НС1, R–C1, R–COC1; р-ции окисления и дегидратации.
Холин является составной частью фосфолипидов. Особенно его много в нервных тканях, мозге, печени, мышцах сердца, почках. Его производное – ацетилхолин – является нейромедиатором.

|
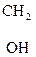 –СН2–N+(СН3)3] ОН– + (СН3СО)2О
–СН2–N+(СН3)3] ОН– + (СН3СО)2О 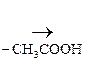 [
[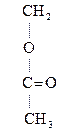 –СН2–N+(СН3)3] ОН–
–СН2–N+(СН3)3] ОН–
Другим важным соединением является нейрин:




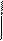
|
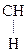 –N+(СН3)3
–N+(СН3)3 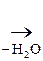 СН2 = СН– N+(СН3)3
СН2 = СН– N+(СН3)3
 |
Большую роль в организме играют аминоспирты, содержащие в качестве структурного фрагмента остаток пирокатехина (1,2-дигидроксибензол, катехол). Они носят общее название катехоламинов.
Катехоламины - представители биогенных аминов, т.е. аминов, образующихся в организме в результате процессов метаболизма. К ним относятся дофамин, норадреналин и адреналин, выполняющие, как и ацетилхолин, роль нейромедиаторов:
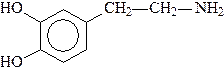
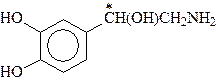
Дофамин Норадреналин
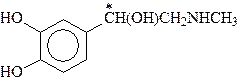
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 818; Нарушение авторских прав?; Мы поможем в написании вашей работы!