
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № 9
|
|
|
|
Липиды, классификация, отдельные представители. Фосфолипиды как структурные компоненты клеточных мембран. Пероксидное окисление липидов
Карбоновые кислоты и их функциональные производные (галогенангидриды, ангидриды, сложные эфиры, тиоэфиры, амиды, соли) также содержат в своем составе карбонильную группу, однако для них характерны реакции нуклеофильного замещения, а не присоединения. Такой результат взаимодействия этих субстратов с нуклеофилами обусловлен их электронным строением.
Реакции нуклеофильного замещения в ряду карбоновых кислот и их производных
Лекция № 7
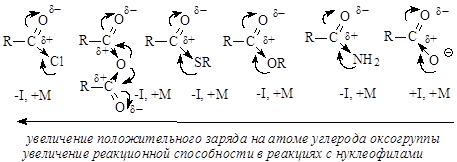
Величина положительного заряда, возникающего на атоме углерода оксогруппы, увеличивается с усилением электроноакцепторного характера заместителя (d+ возрастает с усилением отрицательного индуктивного эффекта по сравнению с положительным мезомерным эффектом). Отличием приведенных выше соединений от альдегидов и кетонов является то, что 2 электрона p-связи углерод-кислород участвуют в сопряжении с неподеленной парой р-электронов гетероатома (атомов галогена, серы, кислорода или азота), что приводит к повышению стабильности соединений. Нуклеофильное присоединение к карбонильной группе этих соединений приводило бы к изменению гибридизации атомных орбиталей углерода с sp2 на sр3 и разрушению системы сопряжения, уменьшению стабильности молекулы. Для сохранения сопряженной системы в реакциях с нуклеофилами после присоединения нуклеофильной частицы происходит отщепление уходящей группы и регенерация сопряжения. В итоге нуклеофильная частица оказывается связанной с ацильной группой – R-C=O, поэтому реакции производных карбоновых кислот называют реакциями ацилирования. Общая схема нуклеофильного замещения имеет вид:
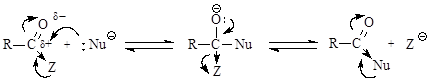
Реакционная способность соединений зависит от величины эффективного положительного заряда на атоме углерода карбонильной группы и от способности к отщеплению уходящей группы Z. В приведенном выше ряду функциональных производных карбоновых кислот справа налево (от солей к галогенангидридам) увеличивается положительный заряд на атоме углерода и увеличивается стабильность уходящей группы, т.е. способность к отщеплению. Реакции ацилирования с участием галогенангидридов карбоновых кислот идут практически необратимо, для связывания кислоты реакцию проводят в присутствии аминов – пиридина или триэтиламина. Уравнение реакции имеет вид:
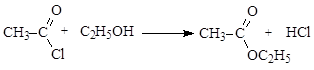
Механизм реакции:
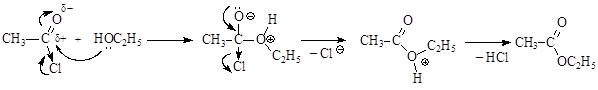
Ангидриды карбоновых кислот несколько менее реакционно способны в реакциях ацилирования вследствие меньшего положительного заряда на атомах углерода карбонильных групп. Меньший положительный заряд в сравнении с галогенангидридами возникает из-за того, что атом кислорода проявляет отрицательный индуктивный эффект по отношению к обеим карбонильным группам. При ацилировании спиртов ангидридами кислот, как и при ацилировании с помощью галогенангидридов, выделяющуюся кислоту связывают добавлением органических оснований.
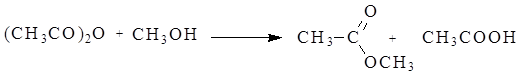
Механизм реакции:
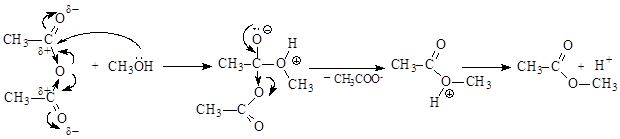
Ацилирование аминов проводят в избытке амина:
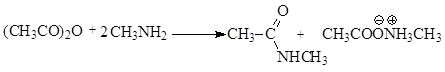
Механизм реакции аналогичен ацилированию спиртов.
Карбоновые кислоты и сложные эфиры карбоновых кислот являются существенно менее реакционноспособными ацилирующими агентами. Снижение реакционной способности обусловлено снижением эффективного положительного заряда на атоме углерода карбонильной группы из-за усиления электронодонорных свойств гидроксильной группы ОН у кислот или алкоксигруппы ОR у сложных эфиров в сравнении с ацильной группой или атомом галогена. Карбоновые кислоты, кроме электрофильного центра, имеют и другие реакционные центры:
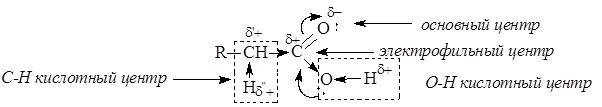
В отличие от альдегидов и кетонов, карбоновые кислоты имеют О-Н кислотный центр, за счет которого проявляют сравнительно сильные кислотные свойства. Сила карбоновых кислот зависит от величины эффективного положительного заряда на атоме углерода карбоксильной группы. Чем больше величина этого заряда, тем сильнее пара электронов атома кислорода гидроксильной группы вовлечена в р,p-сопряжение, тем сильнее поляризована связь и ослаблена связь О-Н, тем легче идет ее разрыв с образованием мезомерно стабилизированного карбоксилат-аниона:
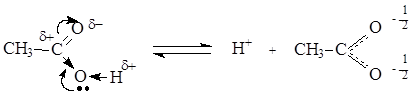
Именно из-за стабильности карбоксилат-анионов и легкости их образования карбоновые кислоты проявляют более сильные кислотные свойства, чем фенолы, тиолы и спирты. Величина эффективного заряда на атоме углерода карбоксильной группы и кислотные свойства зависят от характера радикала, связанного с карбоксильной группой: электроноакцепторные заместители усиливают кислотные свойства соединений, электронодонорные – ослабляют.
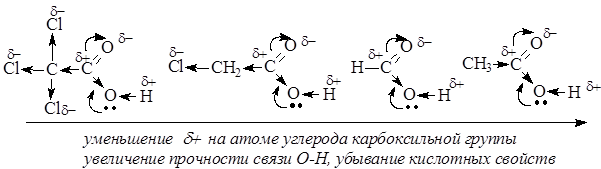
Реакционная способность карбоновых кислот в реакциях нуклеофильного замещения в сравнении с галогенангидридами, ангидридами, тиоэфирами понижена вследствие электронодонорных свойств ОН-группы, уменьшающей электрофильность атома углерода. Для увеличения электрофильности (эффективного положительного заряда) необходимо использовать кислотный катализ. Реакции этерификации карбоновых кислот и гидролиза сложных эфиров протекают в присутствии сильных минеральных кислот как катализаторов. В качестве катализатора часто используют серную кислоту.
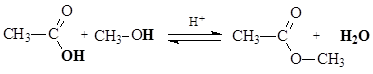
Механизм реакции:
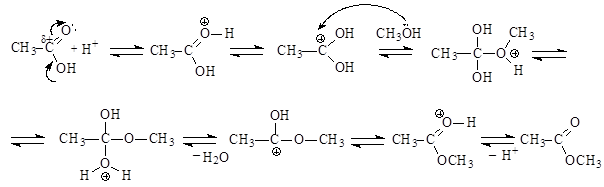
Присоединение протона к основному центру кислоты приводит к образованию карбкатиона - реакционноспособной электрофильной частицы, которая легко подвергается атаке нуклеофилом – молекулой спирта. Образовавшийся оксониевый катион, отщепляя воду, превращается в карбкатион, который регенерирует сопряженную систему путем отщепления протона, что приводит к образованию сложного эфира и возврату катализатора. Ионы водорода катализируют и прямую, и обратную реакции, равновесие реакции можно смещать, используя принцип Ле-Шателье.
Гидролиз сложных эфиров, катализируемый основаниями, протекает необратимо.

Механизм реакции:
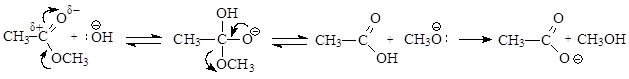
При щелочном гидролизе в результате присоединения нуклеофила – гидроксид-аниона – образуется оксониевый анион, который за счет одновременного образования p-связи углерод-кислород и разрыва s -связи кислород-углерод дает карбоновую кислоту и алкоголят-анион. Алкоголят-анион, являющийся сильным основанием, легко отщепляет протон от молекулы кислоты, в результате образуется молекула спирта и стабильный карбоксилат-анион.
В биологических объектах в качестве ацилирующих агентов выступают тиоэфиры и смешанные ангидриды кислот. Ацетилфосфат и родственные ему соединения образуются при расщеплении АТФ под действием карбоксилат-ионов. Ацетилкофермент А образуется в результате ферментативного расщепления замещенных ацетилфосфатов под действием кофермента А.
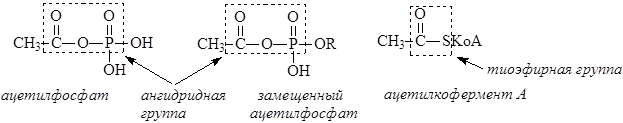
Лекция № 8
Название липиды произошло от греческого слова lipos – жир. Под термином липиды объединяют большую и разнородную группу веществ – жиры и жироподобные вещества, являющиеся органическими соединениями растительного и животного происхождения, различающиеся по составу, но близкие по физико-химическим свойствам. Липиды не растворимы в воде, но хорошо растворяются в неполярных органических растворителях, таких как диэтиловый эфир, бензол, петролейный эфир и др. В живых организмах липиды выполняют следующие функции:
- липиды являются структурными компонентами биологических мембран, обеспечивают их полупроницаемость;
- липиды – форма, в которой организм запасает энергию;
- липопротеиды – транспортная форма липидов, в которой транспортируется запасенная энергия;
- липиды – растворители жирорастворимых витаминов;
- липиды выполняют терморегуляторную функцию;
- липиды образуют защитный слой на клеточных стенках бактерий, листьях высших растений, на коже позвоночных, выполняя т.о. защитную функцию.
Классификация липидов представлена на схеме:
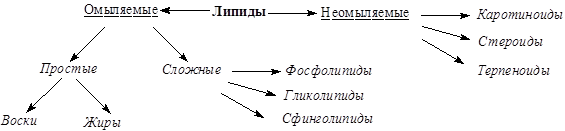
По отношению к гидролизу липиды делят на омыляемые и неомыляемые. К омыляемым липидам относятся вещества, которые гидролизуются водными растворами щелочей (подвергаются омылению). В химическом плане омыляемые липиды являются сложными эфирами. Простые липиды являются двухкомпонентными, так как при щелочном гидролизе образуются два класса органических соединений – спирт и соль карбоновой кислоты. Три и более продукта, относящиеся к разным классам органических веществ, образуются при гидролизе сложных липидов. Таким образом, сложные липиды состоят из трех и более компонентов. Неомыляемые липиды не подвергаются гидролизу и относятся к однокомпонентным соединениям.
Воски представляют собой сложные эфиры, образованные высшими насыщенными жирными кислотами и высшими насыщенными спиртами:
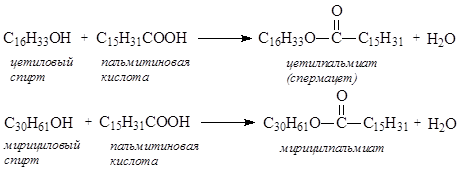
Воски – исторически сложившееся название разных по составу и происхождению продуктов, преимущественно природных, которые по свойствам близки пчелиному воску. Природные воски представляют собой пластичные легко размягчающиеся при нагревании продукты, большинство из которых имеет температуру плавления в интервале 40-90°С. Большинство природных восков содержит сложные эфиры одноосновных насыщенных кислот нормального строения и спиртов с 12-46 атомами углерода в молекуле. Такие воски по химическим свойствам близки к жирам, но омыляются только в щелочной среде.
Жиры – это вещества животного, растительного и микробного происхождения, состоящие в основном (до 98%) из триглицеридов (триацилглицеринов) – полных эфиров глицерина и жирных кислот. В составе жиров содержатся также ди- и моноглицериды (1-3%), фосфолипиды, гликолипиды (0,5-3%), свободные жирные кислоты, стерины и их эфиры (0,05-1,7%), красящие вещества (каротин, ксантофил), витамины А, D, Е и К, полифенолы и их эфиры. Жиры, как и воски, являются двухкомпонентными системами:
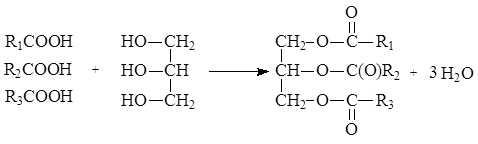
Химические и биологические свойства жира определяются входящими в его состав триацилглицеринами и в первую очередь длиной цепи, степенью ненасыщенности остатков жирных кислот и их расположением в триглицериде. В состав жиров входят в основном неразветвленные углеводородные радикалы жирных кислот, содержащие четное число атомов углерода (от 4 до 26), как насыщенные, так и моно- и полиненасыщенные. Наиболее часто в составе жиров встречаются миристиновая, пальмитиновая и стеариновая кислоты – представители насыщенных одноосновных карбоновых кислот, и олеиновая, линолевая, линоленовая – представители ненасыщенных одноосновных карбоновых кислот.
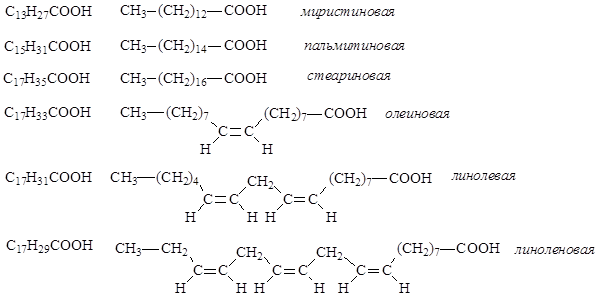
Почти все ненасыщенные кислоты, входящие в состав жиров растительного происхождения, и большинство ненасыщенных кислот, входящих в состав жиров животного происхождения, являются цис-изомерами. Жидкие смешанные триацилглицерины растительного происхождения называют маслами (оливковое, льняное, конопляное и т.д.).
Химические свойства триацилглицеринов
Триацилглицерины, как сложные эфиры, подвергаются гидролизу в щелочной (необратимый) и кислой (обратимый) средах. В организме гидролиз происходит под действием ферментов, называемых липазами, которые активируются желчными кислотами.
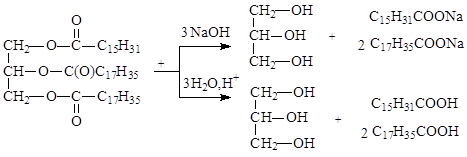
Триацилглицерины, содержащие остатки ненасыщенных жирных кислот, могут вступать в реакции присоединения и окисления по двойным связям, как алкены. При гидрогенизации растительных масел получают твердый продукт, называемый саломас, и используемый для изготовления маргарина.
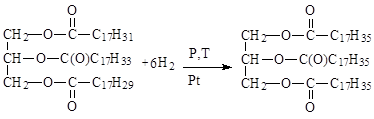
Степень ненасыщенности триацилглицеринов характеризуется йодным числом, которое показывает максимальную массу йода, которая может присоединиться к 100 г жира.
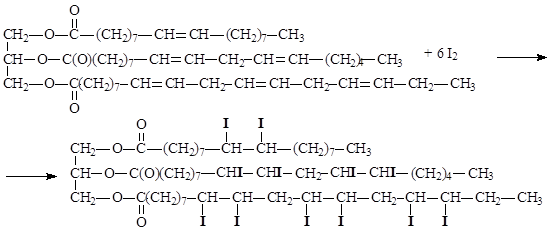
Чем больше значение йодного числа, тем выше степень ненасыщенности триацилглицерина. Ненасыщенные триацилглицерины подвергаются окислению кислородом воздуха, этот процесс сопровождается гидролизом сложноэфирных связей. Окисление двойных связей, сопровождаемое гидролизом, является составной частью процесса прогоркания жиров. Остатки ненасыщенных кислот, входящие в состав липидов, и сами ненасыщенные кислоты окисляются под действием водного раствора перманганата калия с образованием диольных фрагментов по месту двойных связей, окисление в жестких условиях приводит к разрыву двойных связей и образованию карбоновых кислот с меньшим числом атомов углерода.
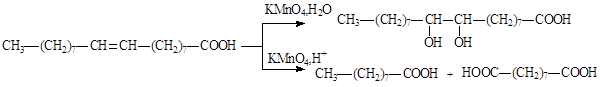
Фосфолипиды представляют собой, также как и жиры, сложные эфиры глицерина. В отличие от триацилглицеринов, третья спиртовая группа глицерина связана не с карбоновой кислотой, а с фосфорной. Другая особенность фосфолипидов состоит в том, что остаток фосфорной кислоты связан сложноэфирной связью с аминоспиртом. Фосфолипиды являются производными фосфатидной кислоты, которая образуется в результате этерификации двух ОН групп глицерина жирными карбоновыми кислотами, а третья ОН группа глицерина этерифицируется фосфорной кислотой.
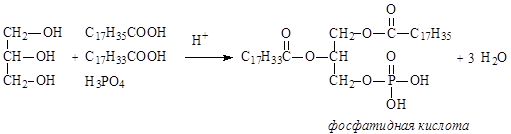
В зависимости от того, какой аминоспирт образует сложный эфир с фосфатидной кислотой, различают фосфатидилколамины (коламинкефалины), фосфатидилсерины (серинкефалины), фосфатидилхолины (лецитины).
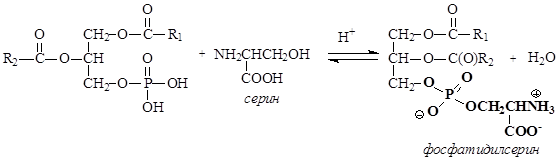
В условиях организма третья гидроксильная группа фосфорной кислоты ионизирована, как и другие ионогенные группы.
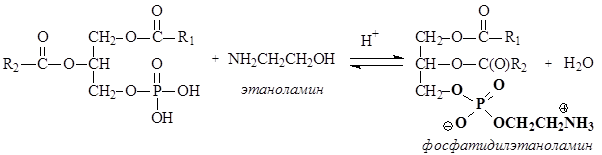
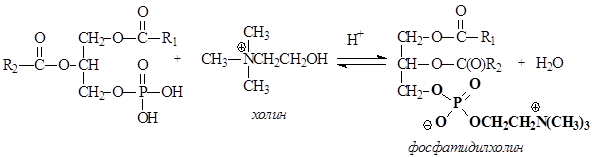
Фосфолипиды являются бифильными веществами, так как содержат в своей структуре неполярные углеводородные радикалы карбоновых кислот (гидрофобная часть) и полярный ионизированный фрагмент, образованный аминоспиртом и фосфорной кислотой (гидрофильная часть), который в формулах выделен жирным шрифтом. Благодаря бифильности, фосфолипиды частично растворимы в воде и способны транспортироваться кровью из печени в органы и ткани, где формируют структуру клеточных мембран.
Как сложные эфиры, фосфолипиды подвергаются гидролизу в кислой или щелочной средах:
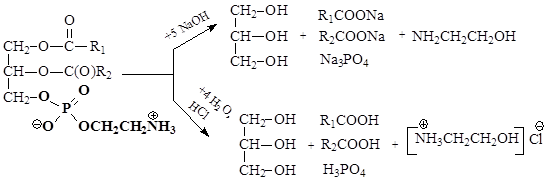
Сфинголипиды, – какпредставители сложных липидов, - представляют собой многокомпонентные соединения. Они являются сложными эфиры двухатомного аминоспирта сфингозина с высшими насыщенными и ненасыщенными кислотами и фосфорной кислотой, которая, в свою очередь, образует также сложноэфирную связь с аминоспиртом.
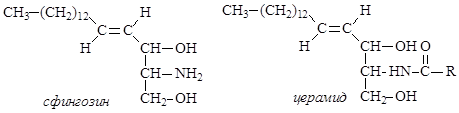
В нервных тканях обнаружены производные сфингозина – сфингомиелины. При гидролизе сфингомиелины образуют одну молекулу жирной кислоты, одну молекулу сфингозина, одну молекулу азотистого основания (чаще это холин) имолекулу фосфорной кислоты. Именно поэтому сфингомиелины относятся к классу фосфолипидов.
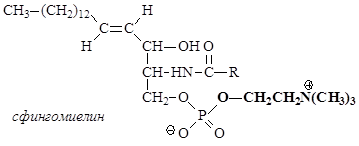
Сфингомиелины являются наиболее распространенными сфинголипидами. Они в основном находятся в мембранах животных и растительных клеток. Особенно богата ими нервная ткань; сфингомиелины обнаружены также в ткани почек, печени и других органов.
Гликолипиды – многокомпонентные соединения, являющиеся производными сфингозина, не содержащими фосфорной кислоты и холина, но содержащие в своем составе углеводный фрагмент. Аминогруппа сфингозина ацилирована высшей жирной кислотой, а гидроксильная группа у первого атома углерода сфингозина связана с остатком углевода (моносахарида или олигосахарида).
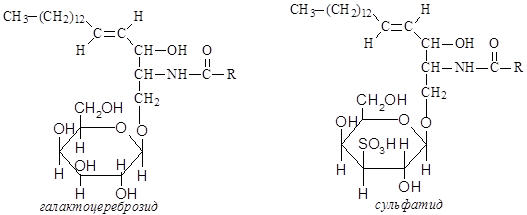
Гликолипиды играют существенную роль в функционировании биологических мембран. Они содержатся преимущественно в ткани мозга, но имеются также в кровяных клетках и других тканях. Известны три основные группы гликолипидов: цереброзиды, ганглиозиды и сульфатиды. В состав цереброзидов входят гексоза (обычно D-галактоза), которая связана гликозидной связью со сфингозином. Кроме того, в состав цереброзида входит жирная кислота, имеющая 24 углеродных атома. Сульфатиды отличаются от цереброзидов тем, что содержат в молекуле остаток серной кислоты, т.е. представляют собой цереброзид, в котором у третьего углеродного атома гексозы образуется сложноэфирная связь с серной кислотой. В мозге млекопитающих сульфатиды, как и цереброзиды, находятся в белом веществе. Однако их содержание в мозге намного ниже, чем цереброзидов. Ганглиозиды в структурном отношении сходны с цереброзидами с той лишь разницей, что вместо одного остатка галактозы они содержат сложный олигосахарид. В отличие от цереброзидов и сульфатидов, ганглиозиды находятся преимущественно в сером веществе мозга и сосредоточены в плазматических мембранах нервных и глиальных клеток.
Фосфолипиды, являясь бифильными веществами, выступают как эмульгаторы на границе раздела фаз. Как и мыла, молекулы фосфолипидов в контакте с водой стремятся расположиться так, чтобы неполярные углеводородные цепи находились в контакте только с другими аналогичными цепями. Таким образом формируется двойной слой толщиной в две молекулы. Такие липидные бислои, содержащие включения мембранных белков, составляют основу клеточных мембран.

Гидрофобные участки мембранных белков размещаются во внутренней полости мембраны, а ионизированные остатки аминокислот находятся на ее поверхности. Вода может проходить через такой двойной слой, а большие полярные молекулы и ионы не проходят. Таким образом, мембраны сохраняют концентрационные различия между различными частями клетки или между клеткой и ее водным окружением. Тонкие различия в физических свойствах клеточных мембран контролируются степенью ненасыщенности остатков жирных кислот в молекулах фосфолипидов. Мембраны, состоящие из ненасыщенных фосфолипидов, являются более мягкими (низкие температуры плавления) и позволяют молекулам проходить через них быстрее, чем через аналогичные мембраны, построенные из сложных эфиров насыщенных кислот. Чтобы полярные вещества и ионы могли пройти через внутреннюю полость мембраны, необходимо участие в этом процессе мембранных белков.
Наряду с процессами нормальной жизнедеятельности в клетке происходят процессы, связанные с нарушением тех или иных функций отдельных ее частей. Одним из процессов «мембранной патологии» является повреждение клеточных мембран, возникающее при воздействии ионизирующих излучений, авитаминозах, отравлениях.
Основной причиной повреждения клеточных мембран является пероксидное (перекисное) окисление липидов, инициируемое свободными радикалами. Свободные радикалы в организме образуются при окислении ионов Fe2+ кислородом или гидропероксидами:
Fe2+ + O2 + H+ ® Fe3+ + H-O-O× +
Fe2+ + R-O-O-H ® Fe3+ + HO- + R-O×
Свободные радикалы возникают и в результате воздействия на клетку ионизирующих излучений. В такой сложной среде, как живая материя, молекулы, являющиеся наиболее распространенными, больше других подвергаются воздействию ионизирующих излучений. При облучении живой материи, на 70-90% состоящей из воды, большая часть энергии излучения будет поглощаться молекулами воды. Рентгеновские лучи, g-излучение, нейтроны сами по себе не вызывают ионизации. Ионизация производится почти исключительно быстрыми заряженными частицами. Рентгеновские лучи, g-излучение, нейтроны называются «ионизирующими» потому, что при прохождении через вещество они вызывают образование быстрых заряженных частиц. Таким образом, особенности воздействия этих излучений связаны с их вторичным действием. В результате действия ионизирующего излучения в воде появляются первичные продукты радиолиза воды – возбужденные молекулы воды, электроны и катион-радикалы Н2О+:
Н2О ® Н2Ó+ + е-
Н2О ® Н2О*
Возбужденные молекулы воды дезактивируются соседними молекулами, однако часть из них распадается на атомы водорода и гидроксильный радикал, или на атом кислорода и молекулу водорода. Образовавшиеся электроны «тормозятся» кулоновским полем «материнских» положительных зарядов, сольватируются и превращаются в частицы радикального характера – гидратированные электроны е- ×Н2О:
Н2О* ® Н× + ×ОН Н2О* ® Н2 + О
Н2О + е- ® е-×Н2О или Н2О-
Н2О+ + Н2О ® Н3О+ + ×ОН
Гидратированные электроны и катион-радикалы воды являются неустойчивыми частицами и далее подвергаются диссоциации с образованием свободного радикала и иона:
е- ×Н2О или H2О- ® Н× + ОН-
Н2Ó+ ® Н+ + ×ОН
Образовавшиеся продукты могут реагировать друг с другом или с молекулами воды:
Н× + ×Н ® Н2 Н2О + Н× ® Н2 + ×ОН
Н× + ×ОН ® Н2О Н2О2 + ×ОН ® Н2О + НÓ2
НО× + ×ОН ® Н2О2 Н3О+ + ОН- ® 2Н2О
При радиолизе воды пероксидные радикалы исчезают в результате рекомбинации: НÓ2 + НÓ2 ® Н2О2 + О2.
В результате протекания указанных реакций в результате радиолиза воды образуются е- × Н2О, ×ОН, Н×, О, Н2О2, Н3О+ и ОН-. Радиационно-химический выход О весьма низок, вследствие чего его образованием при радиолизе воды можно пренебречь. Гидратированный электрон, радикалы Н× и ×ОН называют свободно-радикальными продуктами радиолиза воды, а Н2, О2, Н2О2 – молекулярными продуктами.
Гидроксильный радикал является эффективным окислителем, в реакциях с насыщенными органическими соединениями он реагирует, как правило, отщепляя атом водорода, с ненасыщенными – может присоединяться по двойной связи. В реакциях с ионами металлов переменной валентности гидроксильный радикал выступает как окислитель: Fe2+ + ×ОН ® Fe3+ +:ОН-; Сr2+ + ×ОН ® Cr3+ +:ОН-
Процесс пероксидного окисления липидов можно разделить на три этапа:
I-й этап – инициирование. На этом этапе образуются свободные радикалы, которые атакуют атомы Н метиленовых групп СН2, находящихся в a-положении по отношению к двойной связи. В результате образуются свободные радикалы аллильного типа, стабилизированные р,p-сопряжением.
II-й этап – рост цепи. На этом этапе происходит взаимодействие аллильных радикалов с молекулами кислорода. В результате такого взаимодействия образуются пероксидные радикалы, которые, взаимодействуя с водой или другими водородсодержащими соединениями (RH), отщепляют от них атомы Н. При этом пероксидные радикалы превращаются в неустойчивые гидропероксиды, а из воды или водородсодержащих молекул образуются свободные радикалы (НО× или R×). Образующиеся радикалы (НО× или R×) далее участвуют в реакциях образования аллильных радикалов, т.е поддерживают первый этап реакции – инициирование.
III-й этап – разрыв связей углерод-углерод, находящихся в a-положении по отношению к двойной связи гидропероксидов, в результате чего образуются енолы и альдегиды, которые окисляются далее до соответствующих кислот.
Молекулу фосфолипида, содержащую остаток непредельной кислоты (в данном случае олеиновой), представим как сложный эфир следующим образом:
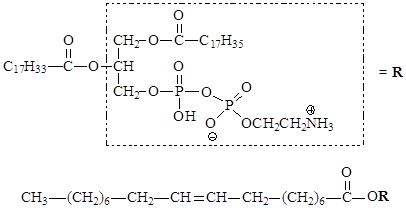
Тогда механизм пероксидного окисления липидов можно представить следующим образом:
Инициирование:
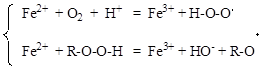
Рост цепи:
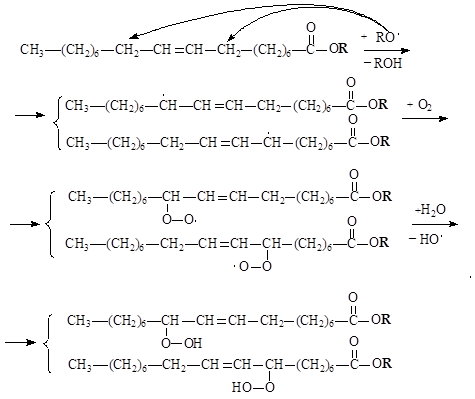
Разрыв углеродных связей:
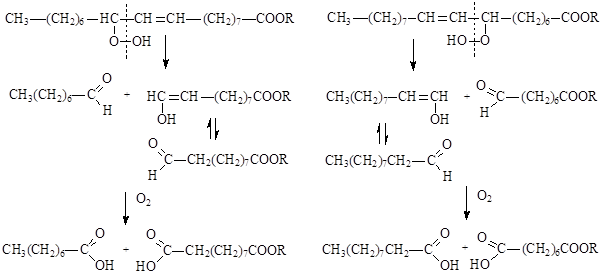
Глубина пероксидного окисления липидов зависит в первую очередь от состава липидов: с увеличением степени ненасыщенности жирных кислот, входящих в состав липидов, скорость окисления возрастает. Пероксидное окисление липидов приводит к повреждению клеточных мембран, структурными элементами которых являются липиды. Антиоксидантами по отношению к ненасыщеным липидам являются витамины группы Е – токоферолы, которые ингибируют процесс пероксидного окисления. Антиокислительная функция токоферолов определяется наличием подвижного атома Н и способностью реагировать с активными радикалами с образованием малоактивных радикалов, стабилизированных р,p-сопряжением.
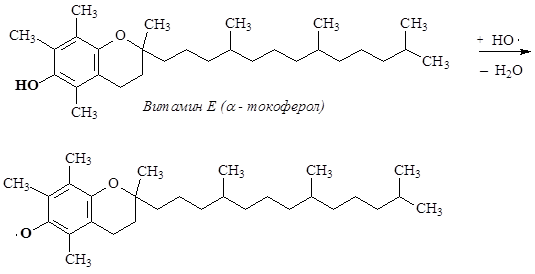
Поли- и гетерофункциональные соединения. Биологически активные гетероциклические соединения. Таутомерия
Соединения, содержащие одну функциональную группу, называют монофункциональными, соединения с несколькими одинаковыми функциональными группами – полифункциональными, соединения с разными функциональными группами – гетерофункциональными. Большинство органических молекул, участвующих в процессах жизнедеятельности и являющихся родоначальниками различных групп лекарственных препаратов, относятся к поли- и гетерофункциональным соединениям.
К наиболее распространенным представителям полифункциональных соединений относятся многоатомные спирты, фенолы, многоосновные карбоновые кислоты, диамины.
Многоатомные спирты представляют собой бесцветные, вязкие жидкости, сладкие на вкус (этиленгликоль –яд), неограниченно растворимые в воде (этиленгликоль, глицерин) или бесцветные сладкие кристаллические вещества, хорошо растворимые в воде (ксилит, сорбит, маннит и др.). Наличие в молекулах этих соединений нескольких гидроксильных групп обусловливает проявление ими типичных химических свойств одноатомных спиртов. В реакции эти соединения в зависимости от условий вступают одной или всеми гидроксильными группами. В то же время наличие в одной молекуле нескольких электроноакцепторных групп ОН приводит к усилению кислотных свойств этих соединений:
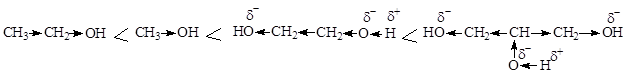
Качественной реакцией на многоатомные спирты является взаимодействие со свежеполученным гидроксидом меди(II), приводящее к образованию внутрикомплексных солей, имеющих интенсивный синий цвет.
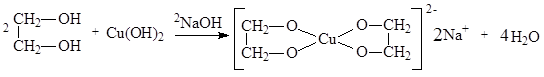
Этиленгликоль используется для изготовления антифризов, для получения полимеров, глицерин – для получения взрывчатых веществ, лекарственных препаратов, полимеров, как компонент смазок, кремов, парфюмерных и косметических препаратов, медицинских мазей, как мягчитель для тканей, кожи, бумаги.
Ксилит, сорбит получают восстановлением моносахаридов:

Ксилит, сорбит обладают желчегонным и послабляющим действием, организмом человека не усваиваются. Применяются вместо сахара в производстве кондитерских изделий для больных диабетом и ожирением.
Многоатомные фенолы – пирокатехин, резорцин, гидрохинон, пирогаллол входят в состав многих природных соединений. Эти соединения широко используются для получения лекарственных препаратов, взрывчатых веществ, красителей, как аналитические реагенты, как восстановители в фотографии.
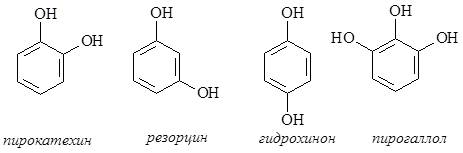
Многоатомные фенолы, подобно фенолу, являются слабыми ОН-кислотами, имеющими несколько констант диссоциации. Для них, как и для фенола, характерна реакция с FeCl3, приводящая к образованию окрашенных продуктов: пирокатехин дает зеленую окраску, резорцин – темно-фиолетовую, гидрохинон – черно-фиолетовую. Как и фенол, многоатомные фенолы легко вступают в реакции электрофильного замещения – подвергаются галогенированию, нитрованию, ацилированию. На воздухе легко окисляются, особенно легко происходит окисление пирокатехина и гидрохинона с образованием, соответственно, 1,2-бензохинона и 1,4-бензохинона.
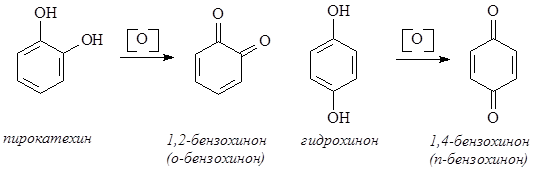
Хиноны содержат своеобразную систему сопряженных связей, называемую хиноидной группировкой. Она состоит из двух двойных связей в цикле и двух карбонильных групп. Соединения, содержащие хиноидную группировку, широко распространены в природе и могут выступать в качестве стимуляторов роста, антибиотиков, участвовать в окислительно-восстановительных процессах, сопровождающих дыхание.
Окислительно-восстановительные свойства системы хинон-гидрохинон играют важную роль в организме. По отношению к большинству органических субстратов эта система выполняет роль окислителя:
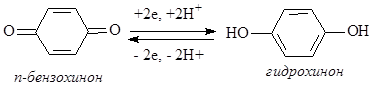
Принимая электроны от субстрата, замещенный хинон in vivo (в организме) превращается в соответствующий гидрохинон, который, в свою очередь, передавая электроны (через цитохромную систему) кислороду, обратно превращается в хинон.
Дикарбоновые кислоты – органические соединения, содержащие две карбоксильные группы. Дикарбоновые кислоты представляют собой кристаллические вещества, растворимые в воде. Первая константа диссоциации дикарбоновых кислот выше, чем у соответствующих монокарбоновых кислот, что особенно заметно у низших гомологов. Дикарбоновые кислоты проявляют все свойства монокарбоновых кислот, образуя как моно-, так и дипроизводные. При достаточной удаленности карбоксильных групп молекулы дикарбоновых кислот могут подвергаться дегидратации с образованием циклических ангидридов. Особенно легко этот процесс идет, если образуется стабильный пяти- или шестичленный цикл:
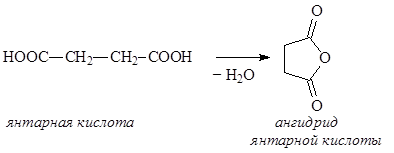
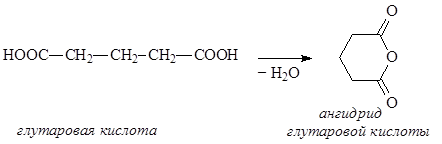
Диамины – органические соединения, содержащие в молекуле две аминогруппы. В природе чаще всего встречаются пента- и тетраметилендиамины Н2N(CH2)nNH2, где n = 5 и 4, содержащиеся в продуктах гнилостного распада белков – соответственно, кадаверин и путресцин. Эти диамины образуются при ферментативном декарбоксилировании,соответственно, лизина и орнитина:
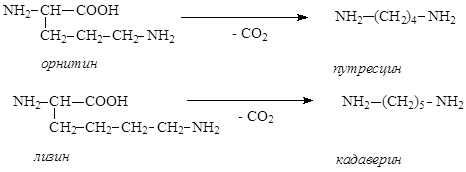
Кадаверин найден в спорынье, мухоморе, сыре, пивных дрожжах. Путресцин используется как исходное соединение для синтеза физиологически активных полиаминов – спермидина и спермина.
Аминоспирты классифицируют по расположению аминогруппы относительно гидроксильной группы:
a-Аминоспирты. Молекулы этих соединений содержат амино- и гидроксильную группу у одного и того же атома углерода. Такие соединения обычно очень неустойчивы и стабилизируются путем отщепления воды либо аммиака:
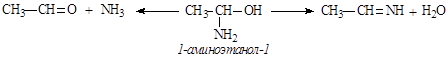
b-Аминоспирты. В молекулах этих веществ аминогруппа и гидроксильная группа содержатся у соседних атомов углерода:
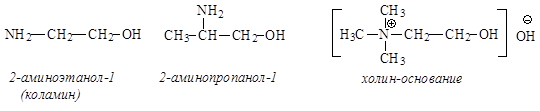
g-Аминоспирты. В молекулах этих соединений атомы углерода, связанные с аминогруппой и гидроксильной группой, разделены одним атомом углерода:
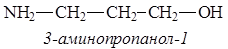
Наибольшее биологическое значение имеют b-аминоспирты – коламин и холин. Они и их производные являются структурными компонентами многочисленных биологически активных соединений: фосфолипидов, биогенных аминов, лекарственных препаратов.
Коламин может быть легко синтезирован из этиленоксида или этиленимина:
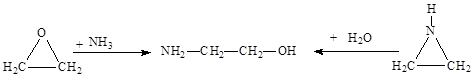
В организме коламин образуется в результате декарбоксилирования серина:
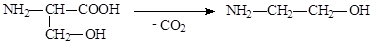
Холин-основание можно синтезировать из этиленоксида, действуя на него триметиламином или из коламина путем алкилирования галогеналканами:
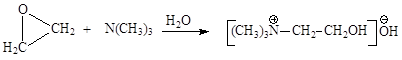
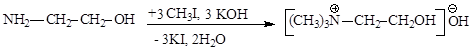
Холин физиологически активен и играет в организме человека и животных важную роль. Он понижает кровяное давление, участвует в регуляции жирового обмена, транспорте жиров, в метаболизме углеводов и белков.
Важную биологическую роль играет ацетилхолин (сложный эфир холина и уксусной кислоты), являющийся нейрогормоном. Он участвует в передаче нервных импульсов к клеткам нервных узлов и мускульным волокнам. Ацетилхолин в организме быстро гидролизуется под действием фермента ацетилхолинэстеразы до холина и уксусной кислоты. Его синтезируют из холина и ангидрида уксусной кислоты:
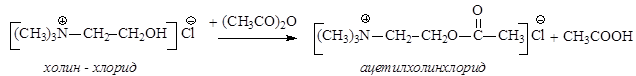
В организме ацетилхолин синтезируется из свободного холина и ацетилкофермента А:
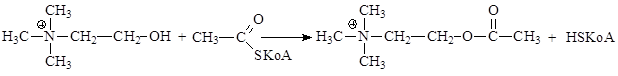
В медицинской практике широко используются производные b-аминоспиртов:
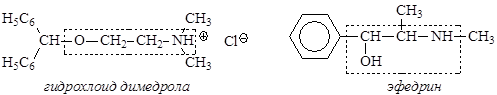
Димедрол используется в качестве противоаллергического препарата, обладает слабым снотворным действием. Эфедрин используется как сосудорасширяющее средство.
Большое значение имеют также другие представители гетерофункциональных соединений – аминофенолы, содержащие в своей структуре остаток двухатомного фенола – пирокатехина (катехола или 1,2-диоксибензола). Группу биогенных аминов, являющихся производными пирокатехина (катехола) и осуществляющих регуляцию функций эндокринных желез и передачу нервных импульсов, называют катехоламинами. Катехоламины рассматривают как гормоны и нейромедиаторы. К биогенным катехоламинам относятся дофамин, L-норадреналин и L-адреналин.
Основная функция дофамина – медиатор центральной нервной системы. Нарушение синтеза дофамина в мозгу обнаружено при болезни Паркинсона. Адреналин участвует в регуляции сердечной деятельности, обмена углеводов. L-Адреналин – гормон мозгового слоя надпочечников человека и животных (D-энантиомер в 15 раз менее активен). Взаимодействуя с адренорецепторами, вызывает сужение мелких кровеносных сосудов, повышение артериального давления, усиление работы сердца, расслабление мускулатуры бронхов и кишечника. Связываясь со специфическими рецепторами гликогенсодержащих клеток, стимулирует фермент аденилатциклазу, ответственный за синтез циклического аденозинмонофосфата. Последний, в свою очередь, активирует каскад ферментативных реакций, приводящих, в частности, к расщеплению гликогена и повышению содержания глюкозы в крови. Адреналин также стимулирует распад триглицеридов (жиров) в тканях и усиливает катаболические процессы. При эмоциональных переживаниях, особенно в стрессовых ситуациях, усиленной мышечной работе, охлаждении, понижении уровня сахара содержание адреналина в крови резко возрастает, что обеспечивает адаптацию организма к новым условиям.
Биосинтез этих катехоламинов осуществляется из фенилаланина через тирозин по схеме:

Гидрокси- и аминокислоты, как гетерофункциональные соединения, проявляют типичные свойства как карбоновых кислот, так и свойства спиртов или аминов. Однако для них характерны и специфические реакции, обусловленные взаимным расположением функциональных групп.
При нагревании a-аминокислоты подвергаются межмолекулярной дегидратации с образованием устойчивых шестичленных гетероциклов – дикетопиперазинов:
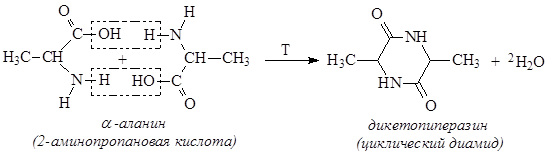
При нагревании a-гидроксикислоты образуют лактиды как результат межмолекулярного отщепления воды:
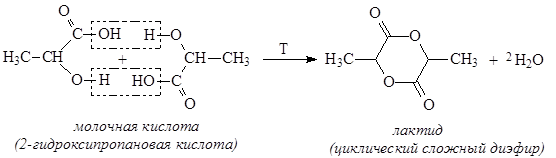
При нагревании a-гидроксикислот с серной кислотой происходит их превращение в карбонильное соединение и муравьиную кислоту, которая дальше разлагается на угарный газ и воду:
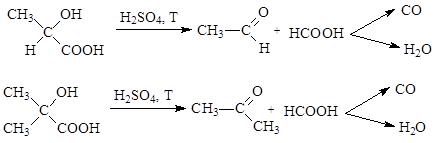
Нагревание b-амино- и b-гидроксикислот ведет к внутримолекулярному отщеплению аммиака или воды и образованию a,b-непредельных кислот:
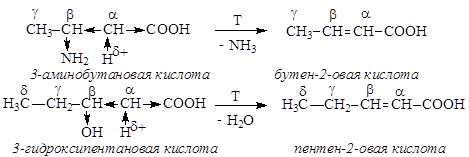
Легкость отщепления NH3 или H2O обусловлена возникновением в a-положении С-Н кислотного центра из-за влияния двух электроноакцепторных заместителей.
Нагревание g-амино и g-гидроксикислот приводит к образованию пятичленных гетероциклов – лактамов и лактонов - в результате внутримолекулярной дегидратации:
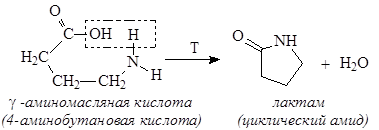
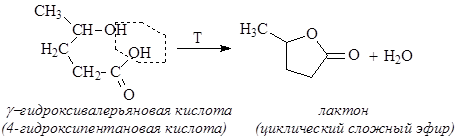
Оксокислоты часто встречаются в живых тканях, участвуют в процессах метаболизма. Наибольшее значение имеют a- и b-оксокислоты.
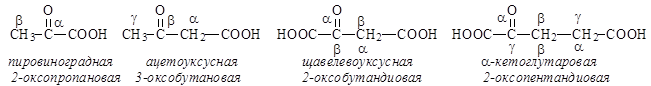
Как гетерофункциональные соединения, они проявляют свойства как кислот, так и кетонов или альдегидов:
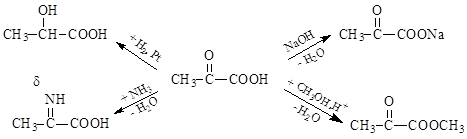
Оксо-группа, содержащаяся в оксокислотах, являясь электроноакцепторным заместителем, усиливает их кислотные свойства за счет проявления отрицательных индуктивного и мезомерного (при наличии сопряженной системы) эффектов:
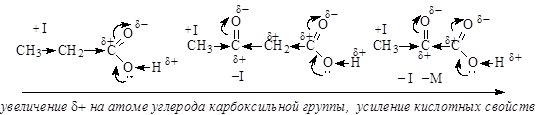
При наличии двух карбоксильных групп в молекулах оксокислот более сильные кислотные свойства проявляет та карбоксильная группа, ближе к которой расположена оксогруппа. Из-за более близкого расположения электроноакцепторного заместителя на атоме углерода такой карбоксильной группы возникает больший частичный положительный заряд и связь О-Н поляризуется в большей степени, что приводит к усилению кислотности. Присутствие в молекулах двух сильных электроноакцепторных заместителей приводит к возникновению С-Н кислотного центра, благодаря которому для оксокислот характерна кето-енольная таутомерия.
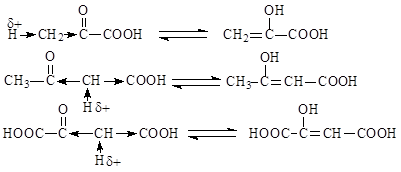
Обнаружить енольную форму кетокислот можно с помощью качественных реакций. При взаимодействии с FeCl3 енольный гидроксил (как и фенольный) дает характерное фиолетовое окрашивание, а при взаимодействии с бромной водой наблюдается ее обесцвечивание за счет протекания реакции по двойной связи.
Оксокислоты, в молекулах которых оксогруппа находится в a- или b-положениях, легко декарбоксилируются. a-Оксокислоты подвергаются окислительному декарбоксилированию под действием мягких окислителей (Cu(OH)2, Ag2O и т.п.):
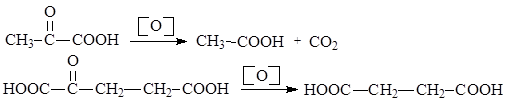
b-Оксокислоты неустойчивы и самопроизвольно декарбоксилируются при комнатной температуре.
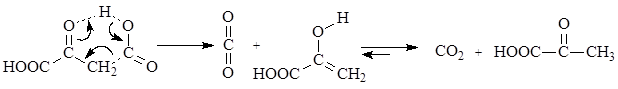
Легкость декарбоксилирования этих соединений обусловлена синхронным переносом протона от карбоксильной группы к карбонильной через образование внутримолекулярного переходного состояния.
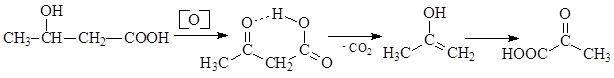
Ацетоуксусная кислота, образующаяся в организме в результате окисления b-оксимасляной кислоты, декарбоксилируется аналогичным образом.
b-Оксимасляная кислота, ацетоуксусная кислота и ацетон объединяются в клиническом анализе в группу «кетоновых тел». В моче здорового человека кетоновые тела содержатся в ничтожно малых количествах (не более 0,01г в сутки). В моче больных сахарным диабетом содержание кетоновых тел намного больше. Наряду с сахарным диабетом, кетоновые тела выделяются с мочой при голодании, исключении углеводов из пищи. Кетоновые тела можно обнаружить с помощью галоформной реакции. В эту реакцию вступают соединения, имеющие ацетогруппу СН3-С(О)-.
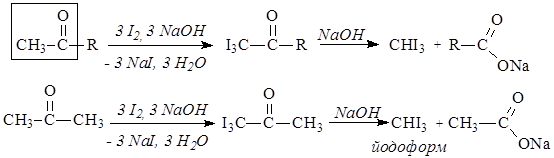
Галоформную реакцию используют в аналитических целях, констатируя образование йодоформа по характерному запаху.
Биологически активные гетероциклические соединения
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 3676; Нарушение авторских прав?; Мы поможем в написании вашей работы!