
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия Гиббса. Второе начало термодинамики
|
|
|
|
Второе начало термодинамики. Энтропия
Энтропия (S)– это мера неупорядоченности состояния системы; стремление частиц (молекул, ионов, атомов) к хаотическому движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному. Энтропия системы возрастает с увеличением движения частиц при нагревании, испарении, растворении, плавлении, расширении газов, при ослаблении или разрыве связей между атомами, при увеличении числа молекул газообразных веществ при химических реакциях и т. д. Процессы, связанные с упорядоченностью системы (конденсация пара, кристаллизация, сжатие газа, уменьшение числа молекул газообразных веществ, упрочнение связей, полимеризация), сопровождаются уменьшением энтропии.
Изменение энтропии системы в результате протекания химической реакции (∆Sхр) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ.
∆Sхр0 = ∑S0 продуктов реакции - ∑S0 исходных веществ,
где Sо – стандартная энтропия, Дж/моль К, (справочная величина),.
Например, изменение энтропии в результате протекания химической реакции
aA + bB = сС + dD
∆S0х.р.= (сS0С + dS0D ) – (aS0A + bS0 B).
Понятие энтропии лежит в основе второго начала термодинамики: в изолированных системах самопроизвольно идут только те процессы, которые сопровождаются возрастанием энтропии 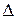 S > 0.
S > 0.
Однако, если в системе протекает химическая реакция, то система обменивается энергией с окружающей средой, т.е. не является изолированной. Химические реакции обычно сопровождаются изменением, как энтропии, так и энтальпии.
В процессе химических реакций действуют две тенденции:
1. 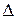 Н
Н  min (энтальпийный фактор);
min (энтальпийный фактор);
2. 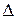 S
S 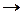 max (энтропийный фактор).
max (энтропийный фактор).
Оба эти фактора действуют во взаимно-противоположных направлениях и течение реакции определяется тем из них, который преобладает в данном конкретном случае. Изменение энтальпии и энтропии при химической реакции учитывает энергия Гиббса ∆G (кДж):
∆G0х.р. = ∆Н0х.р – Т∆S0х.р. ,
где Т – абсолютная температура, ∆S0х.р. – стандартное изменениеэнтропии;
∆Н0х.р – стандартное изменение энтальпии.
Величина и знак 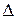 G определяют возможность самопроизвольного протекания химической реакции и ее направление. При постоянной температуре и давлении реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса.
G определяют возможность самопроизвольного протекания химической реакции и ее направление. При постоянной температуре и давлении реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса.
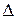 G < 0 - реакция идет самопроизвольно в прямом направлении;
G < 0 - реакция идет самопроизвольно в прямом направлении;
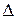 G > 0 - при данных условиях реакция в прямом направлении не идет;
G > 0 - при данных условиях реакция в прямом направлении не идет;
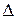 G = 0 - реакция обратима (химическое равновесие).
G = 0 - реакция обратима (химическое равновесие).
Изменение ∆Gх.р не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ.
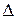 G0хр = Σ∆ f G0продуктов реакции - Σ∆ f G0исходных веществ
G0хр = Σ∆ f G0продуктов реакции - Σ∆ f G0исходных веществ
Например, стандартная энергия Гиббса реакции аА + вВ = сС + dD
∆G0х.р. = (с∆ f G0С + d∆ f G0D) – (a∆ f G0A + b∆ f G0B),
где ∆ f G0– стандартная энергия Гиббса образования вещества, кДж/моль, (справочная величина). Энергия Гиббса образования простых веществ равна нулю.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 672; Нарушение авторских прав?; Мы поможем в написании вашей работы!