
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворение
|
|
|
|
Рис. 10.1. Изотермы набухания высокомолекулярных веществ
1- ограниченное набухание, 2 – неограниченное набухание
Изотерма 1 соответствует ограниченному набуханию, характерному в первую очередь для пространственных полимеров. Оно характеризуется тем, что степень набухания через какое-то время достигает определённого значения, после чего перестаёт изменяться, а образец ВМВ переходит в состояние студня. Если набуханию подвергается образец, погружённый в растворитель, то при этом образуется система из двух фаз, находящихся в равновесии: насыщенный раствор растворителя в полимере, т. е. студень, и чистый растворитель или раствор ВМВ, как правило, очень малой, часто незначительной концентрации.
Изотерма 2 соответствует так называемому неограниченному набуханию,которое заканчивается растворением полимера. В этом случае в начальной стадии образец ВМВ увеличивается в объёме из-за поглощения растворителя. Затем из-за постепенного перехода в раствор поверхностных макромолекул объём образца постепенно уменьшается, пока он полностью не исчезнет. В результате образуется гомогенная система – раствор полимера. Неограниченное набухание характерно для линейных и, в меньшей степени, разветвлённых полимеров.
Следует отметить, что в зависимости от природы ВМВ и растворителя, а также от температуры набухание даже одного и того же полимера может быть или ограниченным, или неограниченным. Так, желатин в холодной воде набухает ограниченно, а в тёплой или горячей – неограниченно.
Причиной набухания является не простое механическое вхождение молекул растворителя в пустоты или поры, которых в полимере, как правило, нет, а межмолекулярное взаимодействие, в первую очередь сольватация макромолекул. Доказательством этого служат выделение теплоты набухания и уменьшение общего объёма системы (контракция), связанное с ориентацией и уплотнением молекул растворителя в гидратной (сольватной) оболочке. Поэтому процесс набухания всегда специфичен: полимер набухает не в любом, а лишь в определённом растворителе или группе растворителей, с которыми он хорошо взаимодействует. Это взаимодействие связано с полярностью обоих взаимодействующих веществ. Поэтому полярные полимеры набухают в полярных жидкостях (например, белки в воде), а неполярные - в неполярных (например, каучук в бензоле).
Набухание обратимо, и набухший образец после устранения возможности контакта с растворителем вновь уменьшается в объёме.
Если в растворителе, с которым контактирует образец полимера, присутствуют электролиты, они заметно влияют на степень набухания. Причём это влияние обусловлено, главным образом, природой анионов. Как и в других случаях - адсорбция, застудневание и т. д. - это влияние связано со степенью гидратации (сольватации) анионов В соответствии с этим анионы могут быть расположены в лиотропный рядпо влиянию на набухание:
Торможение набухания
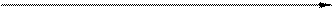 NCS- I- Br- NO3- Cl- CH3COO- SO4-
NCS- I- Br- NO3- Cl- CH3COO- SO4-
 Усиление набухания
Усиление набухания
Набухание всегда сопровождается развитием давления набухания, которое в отдельных случаях достигает десятков и даже сотен атмосфер. Давление набухания эквивалентно внешнему давлению, которое нужно приложить, чтобы предотвратить увеличение объёма набухающего тела. Позняк предложил следующую эмпирическую зависимость между давлением набухания р и концентрацией С сухого ВМВ в набухшем студне:
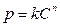 или
или 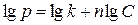 ,
,
где k и n - константы, значение которых определяется природой набухающего вещества и растворителя.
Уравнение Позняка, подобно адсорбционному уравнению Фрейндлиха, не описывает давление набухания после достижения его максимума в результате окончания набухания или растворения полимера.
Приведём некоторые примеры, иллюстрирующие величины давления набухания и его использование. Известно, что лодки, вытащенные на берег, или деревянные бочки, долго хранящиеся пустыми, рассыхаются, в результате чего между досками обшивки или клёпками образуются щели. Для устранения щелей необходимо, чтобы древесина вновь разбухла, для чего лодки и бочки или опускают в воду, или поливают водой. Через сравнительно короткое время после этого доски набухают и так плотно прижимаются друг к другу, что щели полностью смыкаются и не пропускают воду.
С древнейших времён известен способ выламывания больших каменных монолитов без нарушения их целостности, что очень важно в скульптуре и архитектуре. Этот способ заключается в следующем. Вдоль границ предполагаемого монолита сверлится ряд отверстий, в которые забиваются пробки из сухой древесины. Затем эти пробки поливаются водой. Развивающееся давление набухания разрывает даже очень крепкие и вязкие горные породы – граниты, диориты, сиениты, мраморы и др., - в результате чего блок отделяется от материнской породы. При этом внутри монолита не образуется трещин, что неизбежно при добывании монолитов с помощью взрывов или отбойных молотков. Аналогичный способ применяется в анатомии для разделения костей черепа человека и животных. Внутрь черепа помещается сухой горох и заливается водой. Возникающего давления набухания достаточно для того, чтобы отделить друг от друга плоские кости, соединённые извилистыми швами, причём практически без повреждений. В литературе имеется упоминание о корабле с грузом бобов, разорванном пополам в результате попадания в трюм забортной воды через неплотно задраенные люки во время шторма или через небольшую щель в днище.
Для растворения полимеранеобходима его близость по природе, главным образом по полярности, к растворителю. Растворимость в значительной степени зависит от гибкости макромолекул. Наибольшей гибкостью обладают углеводородные цепи без боковых заместителей, в особенности полярных групп. В неполярных жидкостях они растворяются практически неограниченно. Увеличение кристалличности полимера способствует уменьшению взаимодействия с растворителем, поэтому существенно кристаллические полимеры обычно не растворяются даже в жидкостях, близких по полярности.
Растворение ВМВ - процесс самопроизвольный, то есть идёт с уменьшением энергии Гиббса системы DG. В соответствии с общими термодинамическими принципами для него можно записать:
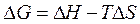 .
.
Рассмотрим влияние на растворение энтальпийной и энтропийной составляющих. Поскольку растворению полимера всегда предшествует набухание, растворение можно рассматривать как процесс, состоящий из двух стадий:
1) диффузия растворителя в полимер (набухание);
2) диффузия полимера в растворитель (собственно растворение).
Энтальпийная составляющая представляет собой тепловой эффект при растворении. Выделение теплоты (D H) при растворении ВМВобусловлено главным образом сольватацией макромолекул, так как способные к растворению аморфные полимеры не имеют кристаллической решётки, и теплота её разрушения для них отсутствует. У кристаллических ВМВ в ходе растворения происходит разрушение кристаллитов, но так как связи между макромолекулами в них, как правило, очень непрочны, то теплотой разрушения решётки можно пренебречь, как очень незначительной величиной. Сольватация макромолекул осуществляется на стадии набухания, поэтому теплоту растворения полимера можно отождествить с теплотой набухания. Обычно её значение невелико, в особенности при набухании неполярных полимеров в неполярных растворителях. В результате сольватации (гидратации) взаимодействие между макромолекулами ослабляется и дальнейшее набухание, а затем и растворение происходит практически без выделения теплоты. Таким образом, энтальпийная составляющая вносит очень небольшой вклад в общее изменение энергии Гиббса.
Вторая стадия растворения характеризуется преобладающим влиянием энтропийного фактора. Энтропия системы возрастает благодаря ослаблению связи между макромолекулами, всё более равномерному распределению их по объёму системы, а также ростом числа возможных конформаций. Конформации – это различные пространственные формы макромолекул, возникающие при изменении относительной ориентации отдельных их частей. Это происходит благодаря возможности свободного вращения атомов или групп атомов вокруг s-связей. В макромолекулах, содержащих сотни тысяч или даже миллионы s-связей, число взаимных расположений сегментов в пространстве чрезвычайно велико. Поэтому энтропийный фактор при растворении ВМВ намного больше, чем при растворении низкомолекулярных веществ, и его доля по сравнению с энтальпийным фактором тоже намного больше.
Так как растворение полимеров связано со значительным ростом энтропии, то и устойчивость образующихся растворов объясняется в основном энтропийным фактором. Его действие проявляется не только в описанных выше эффектах, но и в «расталкивании» макромолекул, заключающемся в участии отдельных фрагментов макромолекул в самостоятельном движении, и в упругом взаимодействии их сольватных оболочек. Энтропийное расталкивание присуще только полимерам, причём при определённых температурах. Этим объясняется существование для многих ВМВ критической температуры растворения.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 653; Нарушение авторских прав?; Мы поможем в написании вашей работы!