
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перманганат-ион и среда
Окислительные свойства калия дихромата.
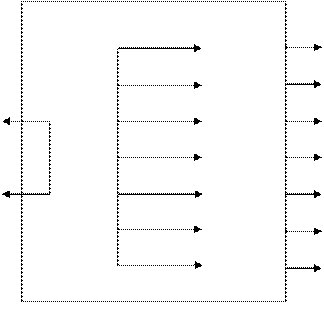 |
HCI
HCI CI2˚
H2SO4
H2S S˚
H2SO4
KCI + CrCI3 + H2O KI I2˚
H2SO4
K2Cr2O7 H2O2 O2˚
H2SO4
K2SO4 + Cr2(SO4)3 + H2O H2C2O4 2CO2˚
H2SO4
FeSO4 Fe2(SO4)3
H2SO4
 Na2SO3 Na2SO4
Na2SO3 Na2SO4
 H2SO4 Zn ZnSO4
H2SO4 Zn ZnSO4
В таблицах в рамку заключены исходные вещества, за рамкой показаны продукты реакции.
Окислительная Восстановительная
форма форма
H+
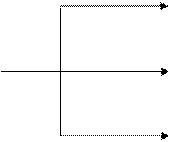 Mn2+ - бесцветный раствор
Mn2+ - бесцветный раствор
H2O
MnO4- MnO2↓ – бурый осадок
OH-
MnO42- - раствор зеленого цвета
При составлении схем полуреакций для окислителя и восстановителя можно использовать следующую таблицу:
| РЕДОКС-РЕАКЦИИ | ||
| pH < 7 кислая | pH = 7 нейтральная | pH > 7 щелочная |
 ок-ль + H+ H2O ок-ль + H+ H2O
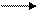 вос-ль + H2O H+ вос-ль + H2O H+
|  ок-ль + H2O 2OH- ок-ль + H2O 2OH-
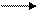 вос-ль + H2O H+ вос-ль + H2O H+
|  ок-ль + H2O OH- ок-ль + H2O OH-
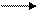 вос-ль + OH- H2O вос-ль + OH- H2O
|
| H2O2 | ||
| ок-льH2O2+2H+ + 2е=2H2O вос-льH2O2 – 2е=O2 + 2H+ | ок-льH2O2 + 2е =2OH- вос-льH2O2 – 2е =O2 + 2H+ | ок-льH2O2 + 2е=2OH- вос-льH2O2+2OH--2е=O2+2H20 |
Задание на дом:
1. Используя таблицы "Окислительные свойства бихромата калия" и "Окислительные свойства перманганата калия" составить молекулярные уравнения всех возможных реакций и расставить в них коэффициенты методом полуреакций и методом электронного баланса.
2. Расставить коэффициенты методом полуреакций в следующих уравнениях:
а) Cu + HNO3 (p.) → Cu(NO3)2 + NO↑ + H2O
б) Zn + H2SO4 (k.) → ZnSO4 + SO2↑ + H2O
в) KMnO4 + Na2SO3 + KOH → Na2SO4 + K2MnO4 + H2O
г) KMnO4 + Na2SO3 + H2O → Na2SO4 + KOH + MnO2
3.Определите степень окисления марганца в следующих соединениях:
MnO2, H2MnO3, Mn(NO3)2, MnCI2, KMnO4.
4.Определите степень окисления хлора в следующих соединениях:
HCI, CI2O, HCIO, HCIO3, KCIO3, Ca(CIO)2.
5.Составьте электронные схемы и укажите, в каких случаях элементы приобретают электроны, а в каких случаях теряют:
а) H2 → 2H+ г) Fe2+ → Fe3+
б) P0 → P3- д) I20 → 2I1-
в) As0 → As3- е) Hg0 → Hg2+
6. Составьте полуреакции, укажите в каких случаях атомы или ионы являются окислителем, а в каких восстановителем:
а) SO32- → SO42- в кислой среде
б) NO3- → NO в кислой среде
в) Cr2O72- → 2Cr3+ в кислой среде
г) MnO4- → MnO2 в нейтральной среде
д) IO3- → I2 в кислой среде
е) As2O3 → AsH3 в кислой среде
7.Какие из перечисленных ниже ионов могут быть в окислительно-восстановительных реакциях окислителями, восстановителями и почему?
S2-, SO32-, CrO42-, S2O32-, NO2-, Cr2O72-, Br-, Pb2+, I-, Fe2+, Fe3+, MnO4-, Mn2+.
8.В электронно-ионных уравнениях определите число электронов, обозначенных через Х:
а) CIO4- + 8H+ + Xē → CI- + 4H2O
б) Br2 + 6H2O - Xē → 2BrO3- + 12H+
в) Sb + 4OH- - Xē → SbO2- + 2H2O
г) IO3- + 2H2O + Xē → IO- + 4OH-
9.Составьте электронно-ионные уравнения для следующих ионных уравнений:
а) 2Fe2+ + CIO- + 2H+ → 2Fe3+ + CI- + H2O
б) Bi0 + NO3- + 4H+ → Bi3+ + NO + 2H2O
в) 2I- + AsO43- + 2H+ → I2 + AsO33- + H2O
г) 5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
10.Какие из следующих реакций являются окислительно-восстановительными, почему?
а) 2Zn + O2 → 2ZnO
б) HCI + NaOH → NaCI + H2O
в) CaO + H2O → Ca(OH)2
г) 4HCIO3 + 3H2S → 4HCI + 3H2SO4
д) 3As + 5HNO3 + 2H2O → 3H3AsO4 + 5NO↑
е) Na2HPO4 + 3AgNO3 → Ag3PO4↓ + 2NaNO3 + HNO3
11.Расставьте коэффициенты в следующих уравнениях методом электронного баланса:
а) KCIO3 → KCI + O2
б) PbO2 + HCI → PbCI2 + CI2 + H2O
в) CuS + HNO3 → Cu(NO3)2 + 3H2SO4 + NO↑ + H2O
г) H2S + H2SO3 → S + H2O
12.Расставьте коэффициенты методом полуреакций:
в кислой среде:
а) KMnO4 + H2SO4+ NaNO2 → K2SO4+ NaNO3 + MnSO4+ H2O
б) NaCIO + KI + H2SO4 → NaCI + K2SO4+ H2O + I2
в) KMnO4 + H2SO4+ KBr → K2SO4+ Br2 + MnSO4+ H2O
г) NaCI + K2Cr2O7 + H2SO4 → Na2SO4+ K2SO4 + Cr2(SO4)3 +H2O + CI2
д) AI + K2Cr2O7 + H2SO4 → AI2(SO4)3+ K2SO4 + Cr2(SO4)3 +H2O
е) KMnO4 + H2SO4+ PH3 → H3PO4 + K2SO4 + MnSO4+ H2O
ж) KMnO4 + H2SO4+ As2O3 → H3AsO4 + K2SO4 + MnSO4+ H2O
в щелочной среде:
а) MnCI2 + KBrO+ KOH → MnO2+ KBr + KCI + H2O
б) MnO2 + KCIO3 + KOH → K2MnO4 + KCI + H2O
в) CrCI3 + Br2+ KOH → K2CrO4+ KBr + KCI + H2O
г) Cr(NO3)3 +Br2 + KOH → K2CrO4 + KNO3 + H2O
д) Cr(OH)3 +Br2 + NaOH → Na2CrO4 + NaBr + H2O
е) KMnO4 + KNO2+ KOH → K2MnO4+ KNO3+ H2O
ж) AI + KNO3+ KOH → NH3 + KAIO2 + H2O
в нейтральной среде:
а) KMnO4 + KNO2 + H2O → MnO2↓+ KNO3+ KOH
б) SO2 + NaIO3 + H2O → NaI + H2SO4 + KOH
в) KBr + KMnO4 + H2O → Br2 + MnO2↓ + KOH
г) Na2SO3 + Br2 + H2O → Na2SO4 + HBr
д) AsH3 + AgNO3 + H2O → H3AsO4 + Ag + HNO3
е) KMnO4 + К2SO3+ H2O → K2SO4+ MnO2↓ + KOH
13.Определите молярную массу эквивалента окислителя и восстановителя в уравнениях реакций:
а) KMnO4 + H2SO4+ NaCI → K2SO4+ Na2SO4 + MnSO4+ CI2
б) S + KMnO4 + H2SO4 → SO2 + K2SO4+ MnSO4 + H2O
в) I2 + Na2S2O3 → NaI+ Na2S4O6
г) KBrO3 + NaCI + H2SO4 → Na2SO4+ CI2 + KBr + H2O
д) H2O2 + KMnO4 + H2SO4 → O2 + K2SO4 + MnSO4 + H2O
е) KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 +H2O + K2SO4
ж) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4+ H2O
|
|
Дата добавления: 2013-12-12; Просмотров: 809; Нарушение авторских прав?; Мы поможем в написании вашей работы!