
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
V. Способы получения
|
|
|
|
IV. Физические свойства.
III. Изомерия.
II. Номенклатура.
По международной (систематической) номенклатуре название алканам дают следующим образом:
1. Выбирают наиболее длинную углеродную цепь, нумеруют атомы
углерода с того конца, к которому ближе находятся боковые цепи,
называют ее с суффиксом –ан на конце.
2. Цифры впереди показывают местоположение боковых цепей.
3. Затем называют радикалы, начиная с простейшего в алфавитном порядке
Если заместители одинаковые, то к их названию добавляют приставки ди, -три, -тетра и т.д.
СН3 — СН — СН — СН2 — СН3
| |
СН3 СН3
2,3-диметилпентан
Для предельных углеводородов характерна структурная изомерия (изомерия углеродной цепи). Начиная с бутана алканы имеют изомеры:
С4Н10
 |  |
СН3 — СН2 — CН2 — СН3 СН3 — СН — СН3

СН3
н-бутан 2-метилпропан
С1 по С4 – газы. С5 по С17 – жидкости, с С18 – твердые вещества
1. Из ненасыщенных углеводородов (реакция гидрирования):
k=Pt,Ni; t=150ºC
 а) CnH2n + H2 CnH2n+2
а) CnH2n + H2 CnH2n+2
t=25 ºC; k=Ni,Pt
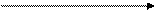 Н3С —СН ═ СН — СН3 + Н2 Н3С— СН2 — СН2— СН3
Н3С —СН ═ СН — СН3 + Н2 Н3С— СН2 — СН2— СН3
бутен бутан
t; k
 б) СnH2n-2 + 2H2 CnH2n+2
б) СnH2n-2 + 2H2 CnH2n+2

 ↓ │ t, k=Pt ↓ │ t, k=Pt
↓ │ t, k=Pt ↓ │ t, k=Pt

 CH = CH + H2 CH2 = CH2 + H2 CH3— CH3
CH = CH + H2 CH2 = CH2 + H2 CH3— CH3

 ↑ │ ↑ │
↑ │ ↑ │
ацетилен этилен этан
(этин) (этен)
2. Из галогенопроизводных (реакция Вюрца). Этой реакцией пользуются, когда необходимо увеличить углеродную цепь.
t˚
R—Hal + 2Na + R—Hal ———→ R—R + 2NaHal


 tº
tº
2CH3 J + 2Na ———→ H3C—CH3 + 2NaJ
 |
иодметан этан
3. Из солей карбоновых кислот:


 t
t
СН3 COONa + NaO H ————→ Na2CO3 + CH4↑
 ацетат натрия крист.
ацетат натрия крист.
4. Прямой синтез из углерода и водорода:
t=400-500ºC, K=Ni
С + 2Н2 ————————————→ СН4↑
5. Из нефти, природного газа.
6. Из карбида алюминия:
Al4C3 + 12H2O ——→ 4Al(OH)3 + 3CH4↑
7. Синтез из угарного газа и водорода:
p, t=200-300ºC, K=Co, Fe
nCO + (2n+1) H2 ———————————→ CnH2n+2 + nH2O
Этим способом получают алканы от С6 до С10.
VI. Химические свойства.
Алканы, по словам Коновалова, «химические мертвецы». Для них характерны реакции замещения.
I. Реакции замещения:
1. Галогенирование. Эта реакция является фотохимической реакцией:
свет свет свет
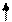




 С Н4 + Сl2 ——→ C H 3Cl + Cl2 ——→C H2 Cl2 + Cl2——→ CHCl3
С Н4 + Сl2 ——→ C H 3Cl + Cl2 ——→C H2 Cl2 + Cl2——→ CHCl3




 - HCl - HCl -HCl
- HCl - HCl -HCl
хлорметан дихлорметан трихлорметан
(хлороформ)
свет
С Н Cl3 + Cl2 ———→ CCl4


 - HCl
- HCl
четыреххлористый углерод
тетрахлорметан
Эта реакция протекает по свободнорадикальному механизму. Впервые этот механизм был изучен русским химиком Семеновым. Такие реакции называют часто цепными реакциями.
2. Нитрование (реакция Коновалова):
СН3 CH3
│ t=140ºC │
 Н3С—СН2—С Н —СН2—СН3 + HNO3 ———→ H3C—CH2—C—CH2—CH3
Н3С—СН2—С Н —СН2—СН3 + HNO3 ———→ H3C—CH2—C—CH2—CH3
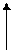 10 % - H2O │
10 % - H2O │
3-метилпентан (HO —NO2) NO2
 азотная 3-метил-3-нитропентан
азотная 3-метил-3-нитропентан
 кислота
кислота
Правило Зайцева: ” Отщепление атомов водорода всегда происходит от наименее гидрогенизированного атома углерода”.
3. Сульфирование:
СН3 СН3
│ H2SO4 t │
СН3—СН2—С—СН3 + НО—SO3H ———→СН3—СН2—С—СН3
│ конц. │
Н SO3H
2-метилбутан 2-метил-2-бутансульфокислота
II. Горение:
t t t
а) СН4+2О2—→СО2↑+2Н2О б) 2СН4+3О2—→2СО+4Н2О в) СН4+О2—→С+2Н2О
избыток недост. недост.
Ш. Разложение:
t=1000ºC
CH4————→ C + 2H2↑
IV. Дегидрирование (отщепление водорода)
t=1500ºС
2СН4 ——————→С2Н2 + 3Н2↑
ацетилен
V. Окисление:
K, t
 ———————→ CH3OH
———————→ CH3OH
муравьиный спирт
O
K, t //
СН4 + nO2 ———————→ H— C
H
муравьиный альдегид
O
K, t //
———————→ H— C
OH
муравьиная кислота
Неполное окисление может происходить без разрыва углеродной цепи, тогда число атомов углерода в молекуле исходного вещества и продукта реакции будет одинаково.
Может такое окисление происходить и с разрывом углеродной цепи.
VI. Крекинг (расщепление, разрыв углеродной цепи)
крекинг
 |  |
термический (пиролиз) каталитический
t=450-700ºC t=400-500ºC
K= Al2O3 + SiO2
Al2O3 + Cr2O3

 C4H8 + H2↑
C4H8 + H2↑
бутен
C4H10 —
 С2Н6 + С2Н4
С2Н6 + С2Н4
этан этен
VII. Изомеризация:
СН3
AlCl3, t 100ºC │
СН3—СН2—СН2—СН3—————→ СН3—СН—СН3
бутан 2-метилпропан
VII. Отдельные представители алканов и их применение.
1. СН4 – метан. Бесцветный газ, без запаха, малорастворим в воде, легче воздуха, называют его ” болотным газом”, так как образуется при гниении растительных остатков на дне болот без доступа воздуха, входит в состав нефтяного, природного газа, используется в органическом синтезе, как топливо.
2. С2Н6 – этан. Бесцветный газ, без запаха, мало растворим в воде, проявляет слабое наркотическое действие, используется как сырье в органическом синтезе.
 3. С3Н8 – пропан Бесцветные газы, легко сжимаются, в быту используются как
3. С3Н8 – пропан Бесцветные газы, легко сжимаются, в быту используются как
С4Н10 – бутан топливо (балонный газ), используется как автомобильное топливо.
Бутан используют для получения бутадиена, который является
сырьем для производства синтетического каучука.
4. Вазелиновое масло – смесь жидких алканов до С15. Бесцветная жидкость без запаха, без вкуса, используется в медицине и парфюмерии. Его используют в технике как основу кислотностойких и неокисляющихся смазочных масел.
5. Вазелин – смесь жидких и твердых алканов до С25. Используется в косметике и в медицине как мазевая основа, в физиотерапевтических процедурах.
6. Парафин – смесь твердых алканов с С18 до С35. Применяется для пропитки материалов (бумаги, ткани. древесины). В медицине используют для физиотерапевтических процедур.
7. Озокерит, горный воск – природная смесь высших алканов. В медицине используют для физиотерапевтических процедур.
Задание на самоподготовку.
1. Записать все возможные изомеры бутана, пентана, гексана. Дать им названия по международной номенклатуре.
2. Сколько веществ изображают следующие формулы:
а) СН3—СН2—СН2—СН3; б) СН3 СН3; в) СН3—СН—СН3;
│ │ │
СН2—СН2 СН3
 СН3
СН3
г) СН—СН3; д) СН3—СН2 е) СН3 СН3


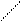 │
│
СН3 СН2
│ СН
СН3 │
СН3
ж) (СН3)2СН—СН3; з) СН2 — СН2
│ │
СН3 СН3
2) Какие из перечисленных соединений являются изомерами:
СН3
│
а) СН3—СН—СН2—СН2—СН3; б) СН3—С—СН3;
│ │
СН3 СН3
СН3
│
в) СН3—С—СН2—СН3; г) СН3—СН—СН—СН3; д) СН3—СН—СН3
│ │ │ │
СН3 СН3 СН3 СН3
3) Назовите следующие углеводороды:
CН3
│
а) СН3—СН—СН2—СН—СН2—СН3; б) СН3—С—СН3;
│ │ │
СН3 СН3 СН2
│
СН3
CН3
│
в) СН3—СН2—С—СН2—СН3; г) СН3—СН—С2Н5.
│ │
СН3 С3Н7
4) Напишите структурную формулу, отвечающую названию 2,2,4 – триметилпентан.
5) Составьте структурные формулы: а) 2 – метил – 4 – этилгексана;
б) 2 – метил – 4,4 – диэтилоктана; в) 2,2,3 – триметилбутана.
Циклоалканы.
Это углероды циклического строения с общей формулой СnH2n, содержащие в цикле только одинарные σ – связи. Для циклоалканов характерно 3 вида изомерии:
1. Размер цикла, то есть количество атомов углерода:
 Н2С — СН2 Н2С СН— СН3
Н2С — СН2 Н2С СН— СН3


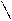
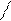 4 1
4 1
Н2С СН2 3 2


 Н2С СН2
Н2С СН2
СН2
циклопентан метилциклобутан
2. Положение заместителей в цикле:

 Н2С 5 1 СН—СН3 Н2С 5 1 СН—СН3
Н2С 5 1 СН—СН3 Н2С 5 1 СН—СН3

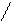
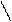
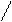
Н2С 4 2 СН—СН3 Н2С 4 2 СН2



 3 3
3 3
СН2 СН—СН3
1,2-диметилциклопентан 1,3-диметилциклопентан
3. Цис- и транс-изомерия:
СН3 СН3 СН3 Н
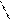
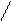



 │С 1 2 │С │С │С
│С 1 2 │С │С │С
Н Н Н Н3С

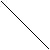
 Н2С 5 3 СН2 Н2С СН2
Н2С 5 3 СН2 Н2С СН2

4
СН2 СН2
цис-изомер транс-изомер
1,2-диметилциклопентан 1,2-диметилциклопентан
Циллоалканы делятся на:
1. Циклоалканы с малыми циклами (С3, С4 )
2. Обычные циклы (С5, С6, С7 …).
Малые циклы.
Неустойчивы, склонны к разрыву. Трехчленный цикл имеет валентный угол 60º, σ-связи образуются при перекрывании sp3-гибридных орбиталей не по прямой, а вне ее. Такое перекрывание не осевое, а приближается к боковому, характерному для π-связей. Такое перекрывание называется «банановое».
Обычные циклы.
Более устойчивы и не склонны к разрыву. Чаще всего встречается циклогексановое кольцо, оно входит в состав терпеноидов, стероидов и т.д.
Химические свойства:
t
1. Горение: С6Н12 + 9О2 ———→ 6СО2↑ + 6Н2О
t
2. Разложение: С6Н12———→ 6С + 6Н2↑
3. Галогенирование:
а) присоединение галогенов:
СН2 t; K

 + Вr2 ——→ H2C—CH2—CH2
+ Вr2 ——→ H2C—CH2—CH2
 Н2С СН2 │ │
Н2С СН2 │ │
циклопропан Br Br
1,3-дибромпропан
б) замещение атомов водорода на галогены:




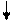

 СН2 CH2
СН2 CH2
6
Н2С СН2 свет H2C 5 1 CH—Cl



 + Сl2 ———→
+ Сl2 ———→
Н2С СН2 - НСl H2C 4 2 CH2


 3
3
СН2 CH2
циклогексан 1-хлорциклогексан
II. Гидрогалогенирование:
СН3
│
СН

 + НВr ———→H3C—CH—CH2—CH3
+ НВr ———→H3C—CH—CH2—CH3

 Н2С СН2 │
Н2С СН2 │
Br
метилциклопропан 2-бромбутан
III. Гидрирование:

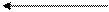

 СН2 t, K=Ni
СН2 t, K=Ni
 + Н2 ————→ Н3С—СН2—СН3
+ Н2 ————→ Н3С—СН2—СН3

 Н2С СН2
Н2С СН2
циклопропан пропан
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1197; Нарушение авторских прав?; Мы поможем в написании вашей работы!