
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратимые и необратимые
|
|
|
|
Процессы самопроизвольные и несамопроизвольные,
Второй закон термодинамики. Энтропия
Первый закон термодинамики позволяет рассчитать тепловые эффекты различных процессов и работу, совершаемую системой, но ничего не говорит о направлении самопроизвольного протекания процесса.
Второй закон термодинамики устанавливает возможность, направление и предел протекания самопроизвольных процессов. С его помощью можно предсказать направление процесса, не прибегая к дополнительному эксперименту, и определить необходимое изменение условий, позволяющее провести процесс в нужном направлении.
Почему многие экзотермические реакции, сопровождающиеся выделением теплоты, не могут протекать самопроизвольно? И почему все-таки протекают эндотермические процессы, подобные испарению? И почему невозможно построить тепловую машину, КПД которой был бы равен 1? На эти вопросы отвечает II закон термодинамики.
Но прежде, чем перейти к изложению сути II закона термодинамики, необходимо дать характеристику самопроизвольным процессам.
Все процессы, протекающие в природе, могут быть разделены на самопроизвольные и несамопроизвольные.
Самопроизвольным, или положительным, называется процесс, который совершается в системе без вмешательства со стороны окружающей среды. Например, переход теплоты от горячего тела к холодному, плавление льда при t > 0 °С.
 Процесс протекает самопроизвольно, если в системе существует градиент соответствующего свойства, т.е. отсутствует симметрия в распределении этого свойства. Например, переход теплоты от горячего тела к холодному происходит потому, что существует градиент температур (Т 1 > Т 2). При равенстве температур никакого переноса тепла не будет.
Процесс протекает самопроизвольно, если в системе существует градиент соответствующего свойства, т.е. отсутствует симметрия в распределении этого свойства. Например, переход теплоты от горячего тела к холодному происходит потому, что существует градиент температур (Т 1 > Т 2). При равенстве температур никакого переноса тепла не будет.
Свойства самопроизвольных процессов.
1) Скорость самопроизвольных процессов измерима (достаточно велика).
2) Достаточно велика и их движущая сила.
3) Самопроизвольные процессы приближают систему к состоянию равновесия, из которого она самопроизвольно выйти не может.
4) Самопроизвольные процессы термодинамически необратимы, т.е. после их протекания систему и окружающую среду одновременно нельзя вернуть в первоначальное состояние: систему можно вернуть в прежнее состояние, затратив работу, но при этом произойдут изменения в окружающей среде (например, изменится энергия окружающих тел).
5) При протекании самопроизвольного процесса совершается работа А н/о (работа необратимого процесса).
Если при осуществлении процесса система может вернуться в исходное состояние, не оставляя видимых изменений в окружающей среде, такой процесс является термодинамически обратимым. При этом в обратном направлении система проходит через те же промежуточные состояния, что и в прямом. Это значит, что в ходе прямого процесса должна производиться работа А обр., достаточная для того, чтобы вернуть систему в исходное состояние без помощи внешней среды.
Термодинамическое понятие обратимости не совпадает со значением этого термина в химической кинетике. Обратимой в кинетике считают реакцию, результирующая скорость которой определяется разностью скоростей протекания ее в прямом и обратном направлениях, причем на величину этой разности не накладывается каких-либо ограничений.
Для термодинамической обратимости требуется, чтобы реакция проходила в условиях, бесконечно близких к равновесию, когда скорости прямого и обратного процессов различаются на бесконечно малую величину.
Основные свойства обратимых процессов.
1) Обратимые процессы идут с бесконечно малой скоростью.
2) Движущая сила обратимых процессов бесконечно мала.
3) Для реализации обратимого процесса система должная пройти через бесконечно большое число стадий.
4) Работа, производимая системой в ходе обратимого процесса, максимальна: А обр. = А max
В природе и технике протекают только необратимые процессы. Но любой реальный процесс можно представить протекающим в условиях, сколь угодно близких к условиям обратимого процесса. Сравнивая реальный процесс с обратимым, можно в каждом конкретном случае указать пути повышения эффективности процесса.
Наилучшей моделью обратимого процесса может служить бесконечно медленно протекающий процесс.
 Воспользуемся известным примером изотермического
Воспользуемся известным примером изотермического
(Т = const) расширения 1 моль идеального газа в цилиндре с поршнем (рис. 1.3). Поршень движется без трения. На поршень помещен груз в виде горки песка, поддерживающий заданное давление газа р 1. Состояние системы описывается двумя параметрами – p и V (рис. 1.4). Кривая AEKB – изотерма равновесия газа. При снятии груза поршень поднимается, объем газа увеличивается, совершается работа расширения.
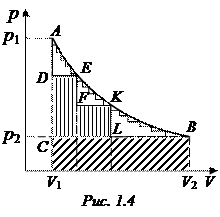 Исходное состояние системы (точка А) характеризуется давлением газа в цилиндре р 1 и объемом V 1, конечное состояние (точка В) – давлением р 2 и объемом V 2. Переход системы из начального состояния в конечное можно осуществить различными путями.
Исходное состояние системы (точка А) характеризуется давлением газа в цилиндре р 1 и объемом V 1, конечное состояние (точка В) – давлением р 2 и объемом V 2. Переход системы из начального состояния в конечное можно осуществить различными путями.
1. Сразу снизить нагрузку на поршень до давления р 2, объем газа резко возрастет и станет равным V 2. При этом совершится работа расширения
A = p 2(V 2 – V 1),
которая равна площади под ломаной кривой АСВ.
2. Процесс можно провести через ряд последовательных стадий, например, снимать с поршня определенные (конечные) порции песка. Как только объем газа достигнет значения, отвечающего новому давлению на поршень, в системе установится равновесие.
Работа возрастет на величину площади фигуры DEFKLC и станет равной
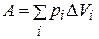 ,
,
где рi – внешнее давление; D Vi – изменение объема, отвечающее данному давлению (при снятии соответствующего груза).
При увеличении числа стадий, т.е. при уменьшении снимаемой нагрузки, работа еще более возрастает.
В пределе, когда снимаемый груз бесконечно мал (снимаем по одной песчинке), а число стадий бесконечно велико, система все время будет приближена к состоянию равновесия. Такой процесс будет обратимым, работа его максимальна:
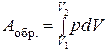 (1.17)
(1.17)
Под интегралом находятся две зависимые переменные – р и V. Произведем замену, используя уравнение состояния идеального газа (1.1):

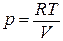 .
.
После подстановки в (1.17)
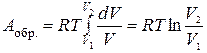 ,
,
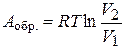 . (1.18)
. (1.18)
Уравнение (1.18) применяется для расчета работы обратимого расширения 1 моль идеального газа.
Выводы:
1) работа обратимо протекающих процессов максимальна, работа реальных процессов всегда меньше;
2) чем выше степень необратимости процесса, тем меньше работа, производимая системой.
Если I закон термодинамики применим к любым термодинамическим процессам в равной мере, то II закон имеет различное выражение при применении его к обратимым и необратимым процессам.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 915; Нарушение авторских прав?; Мы поможем в написании вашей работы!