
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энтропии при протекании процессов в идеальном газе
|
|
|
|
Расчет изменения энтропии при протекании
некоторых процессов
Все процессы, протекающие в природе и технике, являются необратимыми. Для необратимых процессов изменение энтропии связано с приведенной теплотой процесса неравенством:
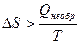 .
.
Следовательно, применяя данное неравенство, изменение энтропии при протекании необратимого процесса вычислить нельзя. Однако энтропия является функцией состояния системы, и ее изменение определяется начальным и конечным состоянием системы и не зависит от пути проведения процесса. Независимо от того, как протекает процесс: обратимо или необратимо изменение энтропии будет одинаковым. Для расчета D S при протекании реального необратимого процесса его можно мысленно разбить на несколько стадий, которые проводятся обратимо. Для каждой стадии вычисляется изменение энтропии на основе уравнения II закона термодинамики для обратимых процессов:
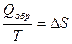
Изменение энтропии в необратимом процессе равно сумме DS всех стадий.
Второй закон термодинамики для бесконечно малых изменений:
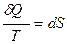 .
.
Преобразуем
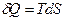 .
.
Согласно I закону термодинамики,
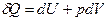 .
.
Изохорная теплоемкость идеального газа
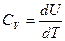 ,
,
тогда
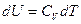 .
.
Согласно уравнению Менделеева-Клапейрона для 1 моль идеального газа
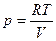 .
.
С учетом этого получим
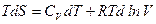
Поделим левую и правую часть уравнения на Т:
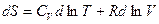 .
.
После интегрирования в определенных пределах получаем
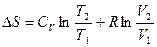 ,
,
а для n моль идеального газа
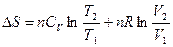 . (1.20)
. (1.20)
Выразим внутреннюю энергию идеального газа через энтальпию:
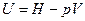 .
.
Найдем dU
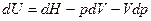
и подставим в уравнение II закона термодинамики:
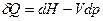 .
.
Выразим объем через давление, используя уравнение Менделеева-Клапейрона:
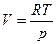 .
.
Изобарная теплоемкость идеального газа:
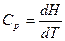 ,
,
тогда
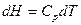
С учетом этого получаем
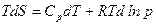
Разделим на Т
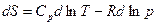 .
.
После интегрирования в определенных пределах для n молей газа
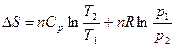 (1.21)
(1.21)
Применим уравнения (1.20) и (1.21) к процессам, протекающим при
V = const, Т = const и р = const.
При V = const V 2 = V 1; ln(V 2/ V 1) = 0, а Т 2/ Т 1 = р 2/ р 1:
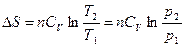 .
.
При р = const Т 2/ Т 1 = V 2/ V 1, тогда
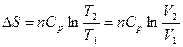 .
.
При Т = const:
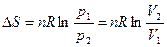 .
.
Изменение энтропии при фазовых превращениях
Фазовое превращение – процесс, связанный с изменением агрегатного состояния вещества.
Характерной особенностью этих процессов является то, что они протекают при постоянной температуре, равной Т ф.п. (температуре фазового перехода).
Согласно II закону термодинамики
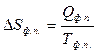 ,
,
где Qф.п. – тепловой эффект фазового перехода.
Для изотермического процесса, протекающего при р = const:
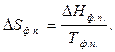
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 874; Нарушение авторских прав?; Мы поможем в написании вашей работы!