
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрическая проводимость растворов электролитов
|
|
|
|
В отсутствие внешнего электрического поля ионы в растворе находятся в непрерывном хаотическом тепловом движении. При возникновении разности потенциалов они приобретают направленное движение от одного полюса к другому: катионы и анионы движутся в противоположных направлениях. Таким образом, возникает электрический ток. В отличие от металлов, которые характеризуются электронным механизмом электропроводности, в растворах электролитов электричество переносится за счет движения ионов. Поэтому электролиты относят к проводникам второго рода.
Количественная характеристика способности системы проводить электрический ток – электрическая проводимость. Единицей электропроводности растворов электролитов служит удельная электрическая проводимость – величина, обратная удельному сопротивлению:
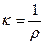 , [Ом-1м-1 = См м-1]
, [Ом-1м-1 = См м-1]
где r – удельное сопротивление
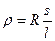 ;
;
R – общее сопротивление проводника, Ом;
l – длина проводника, м;
s – поперечное сечение проводника, м2.
Удельная электрическая проводимость раствора электролита – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь 1 м2 и расположенными на расстоянии 1 м друг от друга.
Удельная электрическая проводимость зависит от
– концентрации электролита;
– вязкости и диэлектрической проницаемости растворителя;
– температуры;
– скорости движения ионов, которая зависит от величины заряда иона и его радиуса с учетом гидратации.
 При увеличении концентрации электролита удельная электропроводность сначала увеличивается, а затем уменьшается. Такая зависимость характерна как для сильных, так и для слабых электролитов. Это объясняется для слабых электролитов уменьшением степени диссоциации, а для сильных – электростатическим взаимодействием между ионами.
При увеличении концентрации электролита удельная электропроводность сначала увеличивается, а затем уменьшается. Такая зависимость характерна как для сильных, так и для слабых электролитов. Это объясняется для слабых электролитов уменьшением степени диссоциации, а для сильных – электростатическим взаимодействием между ионами.
Наряду с удельной электропроводностью в электрохимии используется молярная электрическая проводимость λ – электрическая проводимость, отнесенная к числу моль растворенного вещества в 1 м3 раствора:
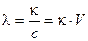 , [См м2 моль-1],
, [См м2 моль-1],
где V – разведение (объем раствора, в котором содержится 1 моль электролита).
Для практических расчетов можно применять производные единицы измерения, например, если выразить концентрацию с в моль/дм3, то связь между молярной и удельной электропроводностью выражается уравнением:
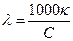 ; [См дм2 моль-1],
; [См дм2 моль-1],
Молярная электрическая проводимость раствора электролита равна электрической проводимости объема раствора электролита, содержащего 1 моль растворенного вещества и находящегося между двумя параллельными электродами площадью 1м2, расположенными на расстоянии 1 м друг от друга.
На рис. кривая I соответствует сильному электролиту, кривая II – слабому электролиту.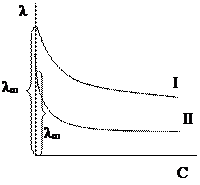 Молярная электропроводность всегда уменьшается с увеличением концентрации электролита, что объясняется электростатическим взаимодействием между ионами. Чем больше ионов в растворе, тем меньше расстояние между ионами и сильнее взаимодействие, таким образом, ионы мешают друг другу перемещаться. С увеличением разбавления молярная электропроводность возрастает и при С ® 0 стремится к предельному значению λ¥. (λ¥ – предельная молярная электропроводность). Поскольку в предельно разбавленном растворе взаимодействие между ионами отсутствует, можно принять, что каждый ион движется независимо от других ионов с максимальной скоростью.
Молярная электропроводность всегда уменьшается с увеличением концентрации электролита, что объясняется электростатическим взаимодействием между ионами. Чем больше ионов в растворе, тем меньше расстояние между ионами и сильнее взаимодействие, таким образом, ионы мешают друг другу перемещаться. С увеличением разбавления молярная электропроводность возрастает и при С ® 0 стремится к предельному значению λ¥. (λ¥ – предельная молярная электропроводность). Поскольку в предельно разбавленном растворе взаимодействие между ионами отсутствует, можно принять, что каждый ион движется независимо от других ионов с максимальной скоростью.
В условиях предельного разбавления выполняется закон независимого движения ионов – закон Кольрауша, согласно которому предельная молярная электропроводность раствора электролита равна сумме молярных электропроводностей катиона и аниона при бесконечном разбавлении:
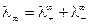 ,
,
где 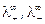 - предельные электропроводности (подвижности) катиона и аниона.
- предельные электропроводности (подвижности) катиона и аниона.
Подвижность иона характеризует количество электричества, которое переносит ион и определяется абсолютной скоростью его движения (т.е. скоростью движения при напряженности электрического поля 1 В/м):
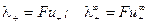 ;
;
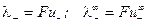 ,
,
где F – число Фарадея F = 96480 Кл/моль;
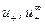 ,
, 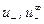 – абсолютные скорости движения катиона и аниона в растворе данной концентрации и при бесконечном разбавлении соответственно.
– абсолютные скорости движения катиона и аниона в растворе данной концентрации и при бесконечном разбавлении соответственно.
Абсолютная скорость движения большинства ионов равна (4 ¸ 8)10-8 м2/(В×с). Исключение составляют только ионы Н+ и ОН–, абсолютные скорости движения которых очень велики.
Абсолютные скорости движения катионов и анионов неодинаковы, то доля электричества, переносимого отдельными ионами может различаться. Для характеристики количества электричества, переносимого данным видом ионов применяют числа переноса. Число переноса – это отношение количества электричества, перенесенного данным видом ионов к общему количеству электричества, перенесенного раствором электролита. Числа переноса катионов t+ и анионов t– можно выразить через электропроводности:
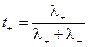 ;
;
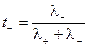 .
.
Таким образом, числа переноса – это относительные подвижности ионов. Сумма чисел переноса катионов и анионов
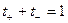 .
.
Влияние межионного взаимодействия на электропроводность раствора отражает коэффициент электрической проводимости fl:
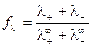 .
.
Взаимосвязь l с fl и степенью диссоциации a можно выразить уравнением:
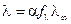 .
.
Для растворов слабых электролитов межионным взаимодействием можно пренебречь, тогда fl» 1, тогда
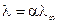
из чего следует
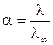 .
.
Таким образом, измерив электропроводность раствора определенной концентрации, можно определить степень диссоциации электролита. Значение λ¥ можно рассчитать по уравнению Кольрауша на основе справочных данных или определить экспериментально. Для этого измеряется электропроводность растворов слабого электролита различной концентрации. В соответствии с законом разбавления Оствальда
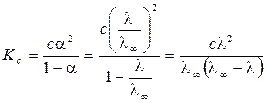 .
.
Приведем уравнение к линейному виду, разделив единицу на правую и левую части:
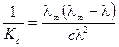 ;
;
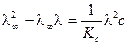 .
.
Разделим на 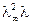 :
:
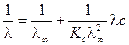 .
.
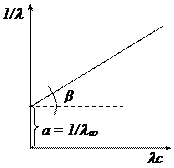 Получили уравнение линейного вида
Получили уравнение линейного вида 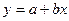 , где
, где 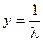 ,
, 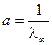 ,
, 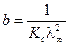 ,
, 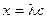 . Для определения λ¥ и Кс строится график в координатах
. Для определения λ¥ и Кс строится график в координатах 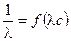 , в соответствии с которым
, в соответствии с которым 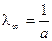 ,
, 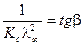 ,
, 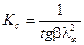 .
.
Зависимость электропроводности раствора слабого электролита от концентрации можно выразить с помощью уравнения Оствальда. Для раствора слабого бинарного электролита (a << 1) в соответствии с законом разбавления Оствальда получим:
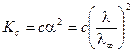 ,
,
тогда
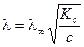 .
.
Из уравнения следует, что молярная электропроводность раствора слабого электролита уменьшается с увеличением концентрации.
Для сильных электролитов α ≈ 1, тогда
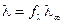 ;
;
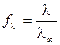 ,
,
следовательно, по значению электрической проводимости раствора данной концентрации можно рассчитать коэффициент электропроводности.
Зависимость молярной электропроводности раствора сильного электролита от концентрации выражается уравнением Онзагера:
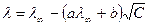 ,
,
где а и b – теоретические коэффициенты, зависящие от диэлектрической проницаемости растворителя, вязкости растворителя и температуры.
Как видно из уравнения Онзагера, с увеличением концентрации электролита электропроводность раствора уменьшается.
С повышением температуры электропроводность растворов электролитов увеличивается. Это объясняется понижением вязкости раствора с возрастанием температуры и увеличением скорости перемещения ионов, а для слабых электролитов также увеличением степени диссоциации.
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 1164; Нарушение авторских прав?; Мы поможем в написании вашей работы!