
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома
|
|
|
|
Основные понятия химии
Часть I. ОБЩАЯ ХИМИЯ
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Конспект лекций
Для студентов I курса
медицинского и аграрного факультетов
Москва
Издательство Российского университета дружбы народов
Утверждено
Редакционно-издательским советом РУДН
Рябов М.А., Линко Р.В.
Общая и неорганическая химия: Учеб. пособие. - М.: Изд-во РУДН. 2000.- 100 с.
Пособие представляет собой конспект лекций, читаемых авторами студентам I курса медицинского факультета (специальность “Лечебное дело”) и аграрного факультета (специальности “Агрономия”, “Ветеринария”, “Зоотехния”). Пособие включает основные разделы курсов общей и неорганической химии
Предназначено для студентов I курса специальностей “Лечебное дело”, “Агрономия”, “Ветеринария”, “Зоотехния”.
Подготовлено на кафедре общей химии РУДН.
ã Российский университет дружбы народов 2000
Химия - наука о составе, строении, свойствах и превращениях веществ. Известны вещества: органические (>10 млн.) и неорганические (>150 тыс.).
В настоящее время известно, что все органические и часть (10-20%) неорганических веществ имеют молекулярное строение, то есть, состоят из молекул. В то же время большинство неорганических веществ (металлы, соли и др.) имеют немолекулярное строение и состоят из атомов, ионов. Например, метан и этанол состоят из молекул, железо состоит из атомов, ионов и электронов, хлорид натрия состоит из ионов. Поэтому можно заключить, что вещества состоят из химических частиц (молекул, атомов, ионов), которые имеют сложное строение и состоят из элементарных частиц (протонов, нейтронов, электронов).
Атом - нейтральная частица, состоящая из положительного ядра и электронов.
Молекула - наименьшая частица вещества, сохраняющая его химические свойства; молекула - устойчивая группа атомов, связанных химическими связями.
Химический элемент - вид атомов с одинаковым зарядом ядра. Элемент обозначают 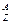 X, где X - символ элемента, Z - порядковый номер элемента, А - массовое число. Порядковый номер Z равен заряду ядра атома, числу протонов в ядре атома и числу электронов в атоме. Массовое число А равно сумме чисел протонов и нейтронов в атоме. Число нейтронов равно разности А-Z. Например, в атоме
X, где X - символ элемента, Z - порядковый номер элемента, А - массовое число. Порядковый номер Z равен заряду ядра атома, числу протонов в ядре атома и числу электронов в атоме. Массовое число А равно сумме чисел протонов и нейтронов в атоме. Число нейтронов равно разности А-Z. Например, в атоме 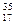 Cl имеется 17 протонов, 17 электронов и 18 нейтронов, а в атоме
Cl имеется 17 протонов, 17 электронов и 18 нейтронов, а в атоме 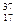 Cl имеется 17 протонов, 17 электронов и 20 нейтронов.
Cl имеется 17 протонов, 17 электронов и 20 нейтронов.
Изотопы - атомы одного элемента, имеющие разные массовые числа. Изотопы имеют одинаковые числа протонов и электронов и разные числа нейтронов. Например, атомы 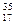 Cl и
Cl и 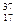 Cl.
Cl.
Относительная атомная масса (Аr) - отношение средней массы атома естественного изотопического состава элемента к 1/12 массы атома изотопа углерода 12С. Атомная масса - среднее значение массовых чисел изотопов. Например, природный хлор состоит на 75% из 35Cl и на 25% из 37Cl. Поэтому Аr(Cl) = 0,75×35 + 0,25×37 = 35,5 а.е.м.
Относительная молекулярная масса (Мr) - отношение средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома изотопа углерода 12С. Относительная молекулярная масса молекулы может быть вычислена как сумма относительных масс атомов, составляющих эту молекулу.
Мr(H2O) = 2Ar(H) + Ar(O) = 18 а.е.м.
Моль - это количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов), сколько содержится атомов в 0,012 кг изотопа углерода 12С. Моль - это количество вещества, содержащее 6,02×1023 структурных единиц (атомов, молекул, ионов).
Число Авогадро NА = 6,02×1023 частиц/моль.
n = N/NA, где n - количество вещества (моль), N - число частиц, а NА - число Авогадро.
Молярная масса М (г/моль) - отношение массы вещества m (г) к количеству вещества n (моль).
Молярная масса численно равна массе одного моля вещества.
М = m/n, откуда имеем: m = M×n и n = m/M.
Молярный объем газа VМ (л/моль) - это отношение объема газа V (л) к количеству вещества этого газа n (моль).
Молярный объем газа численно равен объему одного моля. При нормальных условиях (t = 0оC или Т = 273 К и p = 101325 Па = 760 мм.рт.ст.) один моль любого газа занимает объем 22,4 л, и
VМ = 22,4 л/моль.
VМ = V/n, откуда имеем: V = VM×n и n = V/VM.
| Имеем общую формулу: | n = m/M =V/VM = N/NA |
Эквивалент - реальная или условная частица, взаимодействующая с одним атомом водорода, или замещающая его, или эквивалентная ему каким-либо другим способом.
Молярная масса эквивалентов МЭ - отношение массы вещества к количеству эквивалентов этого вещества:
МЭ = m/n (экв).
В реакциях обмена зарядов молярная масса эквивалентов вещества А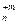 В
В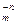 с молярной массой М равна: МЭ = М/(n´m).
с молярной массой М равна: МЭ = М/(n´m).
В окислительно-восстановительных реакциях молярная масса эквивалентов вещества с молярной массой М равна:
МЭ = М/n(е), где п - число переданных электронов.
Закон эквивалентов - массы реагирующих веществ пропорциональны молярным массам их эквивалентов.
m1/m2 = MЭ1/МЭ2 или n1 = n2.
Для растворов закон эквивалентов может быть записан в следующем виде: CN1×V1 = CN2×V2,
где m1 и m2 - массы двух веществ, МЭ1 и МЭ2 - молярные массы эквивалентов, n1 и n2 - количества эквивалентов этих веществ, CN1, CN2 и V1 и V2 - нормальные концентрации и объёмы растворов этих двух веществ.
Объединенный газовый закон. pV = nRT, где имеем:
р - давление (Па, кПа), V - объем (м3, л), n - количество вещества газа (моль), Т - температура (К), T(K) = t(oC) + 273, R - константа,
R = 8,314 Дж/(К×моль), при этом Дж = Па×м3 = кПа×л.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 322; Нарушение авторских прав?; Мы поможем в написании вашей работы!