
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи отримання і культивування протопластів
|
|
|
|
Застосування ізольованих протопластів
Протопласти є унікальною моделлю для вивчення фундаментальних фізіологічних проблем у рослин. Вони незамінні при вивченні складу, структури і функціонування плазмалеми в нормі і при дії на неї гормонами, інгібіторами, фітототксинами, а також при взаємодії самих протопластів в популяції. Крім того, протопласти можуть використовуватися для визначення складу й архітектоніки первинної клітинної стінки та вивчення механізму її репарації після руйнування.
На схемі (рис. 5) представлені основні напрямки фізіологічних досліджень з використанням культури ізольованих протопластів.
Таким чином, ізольовані протопласти мають кілька областей застосування, як теоретичного, так і прикладного характеру:
1. Вивчення хімії та структури клітинної стінки (і при руйнуванні, і при синтезі «de novo»).
2. Вивчення властивостей плазмалеми, трансмембранних переміщень.
3. «М'яке» виділення органел.
4. Спостереження за закономірностями диференціювання клітин при злитті протопластів, відстеження взаємодії ядра і цитоплазми в отриманій гібридній клітині, вивчення соматичних гібридів.
5. Введення чужих органел.
6. Введення чужорідних генів в рослинну клітину (трансгенез).
Виділення протопластів. Протопласт – клітина, позбавлена целюлозної оболонки, оточена цитоплазматичною мембраною, що зберігає всі властивості, притаманні рослинній клітині. Вперше протопласти в 1892 р. виділив Дж. Клеркер, який використовував механічний спосіб. При цьому способі у плазмольованих клітин розрізають клітинну стінку, протопласти виходять в середовище.
В даний час метод зазнав модифікації, поліпшений, але має ряд обмежень: невисока продуктивність; можна використовувати тканини тільки з екстенсивним плазмолізом; трудомісткість і тривалість.
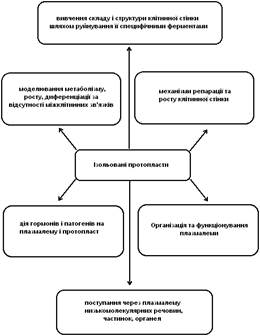
Рис. 5. Ізольовані протопласти – об'єкт і модель у фізіологічних дослідженнях (за Р.Г. Бутенко, 1981)
Інший метод виділення протопластів – ензиматичний, з використанням ферментів. У 1952 році Салтон за допомогою ферменту лізоциму вперше зруйнував клітинну стінку бактерій. У 1960 році Коккінг обробив кінчики коренів томату гідролітичним ферментом з культуральної рідини цвілевих грибів (Myrothecium verrucaria) і вперше отримав ізольовані протопласти вищих рослин ензиматичним способом.
Переваги ензиматичного методу в порівнянні з механічним: одночасно виділяється велика кількість протопластів (до 10 млн. з грама тканини або клітин); клітини не зазнають сильного осмотичного стресу; клітини не ушкоджуються; метод порівняно швидкий.
Для видалення клітинної стінки використовують ферменти трьох типів: целюлази, геміцелюлази і пектинази. Комбінація ферментів та їх співвідношення специфічне для кожного типу клітин.
Виділення протопластів проводять у три етапи:
– обробка ферментами,
– виділення протопластів з клітинних стінок,
– відділення інтактних протопластів від клітинних уламків.
Стандартна методика протопластів (за Такебе) з тканин листа Nicotiana tabacum:
Зрілий сформований листок відокремлюють від дорослої рослини у віці 60 – 80 днів, занурюють у 70% етанол, а потім поміщають на 15 – 20 хвилин в 10% розчин гіпохлориту кальцію і багаторазово промивають дистильованою водою. За допомогою пінцета нижній епідерміс знімають, очищене від епідермісу листя розрізають скальпелем на невеликі шматочки площею 4 см2. Для кращого зняття епідермісу листя повинне трохи зав’яти, можна також обмежити постачання води перед зрізанням листя.
Далі тканину обробляють послідовно або одночасно пектиназою, що викликає мацерацію, і целюлазою, що руйнує клітинні стінки. Оптимальна концентрація ферментів, як і час обробки, індивідуальні для різних тканин. Протопласти повинні знаходитися в розчині ферментів мінімальну кількість часу, після чого слід ретельно їх промити. Ферменти стерилізують через бактеріальні фільтри.
Регулювання водообміну клітини пов'язане з наявністю клітинної стінки. Коли протопласт "голий", один з компонентів регуляції водообміну втрачається, тому важливе значення набувають осмотичні властивості середовища виділення і культивування. Середовище повинне бути трохи гіпертонічним, щоб протопласти перебували в злегка плазмольованому стані. Ці умови гальмують метаболізм і регенерацію клітинної стінки. В якості осмотичних стабілізаторів використовують цукор (глюкозу, маніт, сорбіт, ксилозу), іонні осматики (CaCl2, KCl) в концентрації 0,3 – 0,8 моль/л. Концентрації підбираються індивідуально для кожного рослинного об'єкта.
Зручніше обробляти тканини ферментами в чашці Петрі, яку тримають під кутом 15°. Суміш ферментів з протопластами переносять в центрифужні пробірки. Відокремити протопласти від ферментативної суміші можна двома способами: або фільтрація з центрифугуванням, або флотація.
При фільтрації суміш пропускають через фільтри з розмірами пор 40 мкм. На фільтрі при цьому залишаються грудки клітин і їх великі осколки. При подальшому центрифугуванні осідають протопласти, осколки залишаються в супернатанті. При повторному центрифугуванні йде відмивання від ферменту, після чого протопласти переносяться в середовище для культивування.
Метод флотації запропоновано О. Гамборгом з співробітниками в 1981 році, і призначається для ослаблених протопластів. Він заснований на тому, що протопласти мають більш низьку щільність, ніж органели або залишки клітинних стінок. До вихідної суміші додають розчин сахарози і центрифугують при швидкості від 40 – 80 до 350 g. Чисті протопласти плавають, уламки осідають на дно.
Протопласти можна виділяти також із суспензійних і клітинних культур. Краще за все – в пізній стадії логарифмічного росту, коли клітинні стінки легше піддаються руйнуванню, протопласти найбільш життєздатні.
Далі протопласти культивують в тих же умовах, що й клітини. Склад солей може бути дещо змінений. Середовище складається з осмотичного стабілізатора, неорганічних сполук, джерела вуглецю, азоту, вітамінів, фітогормонів. Умови культивування: рН середовища 5,4 – 5,8, температура 22 – 28ºС, невисока освітленість (не більше 2000 лк).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 4021; Нарушение авторских прав?; Мы поможем в написании вашей работы!