
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Современные направления в развитии термодинамической и прикладной электрохимии
|
|
|
|
Катодные реакции
Катодные и анодные процессы в гальванотехнике
Основными процессами в гальванотехнике являются восстановление и снижение.
На Kat – восстановление, где Kat – катод. На An – снижение, где An – анод.
Электролиз H2O:
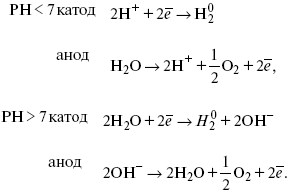
Последняя реакция протекает свыделением водорода.
Наиболее важная стадия любого электрохимического процесса – стадия переноса заряда, она протекает на межфазной границе электрод-электролит в пределах ДЭС, в его плотной части (слой Гельмгольца). Особенностью стадии переноса зарядов является обязательное участие электронов в процессе, источник электронов – металл или электрод; ионы раствора в свободном виде или в виде комплексов диффундируют (перемещаются посредством диффузии к межфазной границе), входят в плотный слой Гельмгольца, то есть адсорбируются на поверхности электрода за счет электростатических сил; в слое Гельмгольца ионы принимают или отдают электрон; процесс переноса электронов, степень переноса заряда с электрода на реагирующую частицу или обратно определяется или зависит от электрического поля ДЭС. Образующиеся продукты реакции уходят в раствор (десорбируются с поверхности) или образуют на поверхности новую фазу, такой новой фазой являются: металлопокрытия (осадки металла), осадки оксидов или нерастворимых солей. С образованием новой фазы дальнейшее протекание процесса будет зависеть от свойств в этой фазе, в частности от диффузии образующихся частиц через слой фазы. В зависимости от соотношения коэффициента диффузии реагирующих частиц в слое фазы, дальнейшее протекание электродного процесса может концентрироваться или на внешней границе новой фазы (раствор электролита), или на внутренней границе, где образовавшаяся фаза соприкасается с электродом. В связи с этим любой электрохимический процесс включает стадии диффузии, адсорбции, переноса заряда, кристаллизации новой фазы. Скорость суммарного процесса будет определяться скоростью самой медленной стадии. Соответственно этому различают электрохимические процессы, протекающие с перенапряжением диффузии, с перенапряжением переноса заряда, перенапряжением кристаллизации. Процесс кристаллизации – частный случай гетерогенной химической реакции. Возможны реакции, скорость которых лимитируется химической реакцией, протекающей у поверхности электрода (перенапряжение гомогенной химической стадии). Кинетические характеристики каждой из лимитирующих стадий можно определить с помощью следующих электрохимических методов: метод гальваностатической кривой – потенциал, время (хронопотенциометрия); метод потенциостатических кривых – плотность тока, время (хроноамперометрия); метод потенциодинамических кривых (хроновольтамперометрия): особенностью метода является то, что изменение? Toка во времени регистрируется параллельно с изменением потенциала. Потенциал на электрод подается с определенной линейной скоростью.
Все эти методы могут использоваться в ячейках с вращающим дисковым электродом. Кинетические характеристики любого электрохимического процесса:? тoкообмена – i 0; константа скорости в стадии переноса заряда – к; энергия активации А; i д – предельный ток диффузии (гетеро); i д – предельный ток реакции (гомо); i кр – предельный ток кристаллизации.
Для них можно использовать метод переменного тока, который позволяет проводить измерения С – емкостной, R – омической составляющей импеданса электрода в условиях, близких к равновесным, в отсутствии внешней поляризации постоянным током, вблизи равновесного потенциала. Твердофазные процессы также характеризуются сложным механизмом, то есть включают несколько стадий: поверхностная диффузия (диффузия в твердой фазе), взаимодействие диффундирующих частиц на поверхности, с образованием зародышей новой фазы, участие их в процессе кристаллизации.
В последние годы накоплен большой экспериментальный материал, который показывает, что электроны могут переходить в раствор и там существовать длительное время в виде самостоятельных частиц. Присутствие электронов в растворе в сольватированном виде может значительно изменять структуру раствора и оказывать влияние на механизм поведения компонентов раствора в ДЭС. Это направление широко развивается, так как открывает возможности для создания принципиально новых технологий, получения новых материалов. Это направление – электронная электрохимия. В настоящее время с помощью различных физико-химических методов достаточно подробно изучена диффузия водорода в металлах и сплавах. Полученные данные способствуют развитию применения водорода в энергетике (топливные элементы и солнечные батареи), а так же радиотехнике и оптоэлектронике. Открытие металлической связи в водородном соединении металлов используется для разработки «элементов памяти», которые способны реагировать на внешние воздействия и восстанавливать свою форму после прекращения такого воздействия. Кроме того, благодаря открытию металлической связи развиваются «аккумуляторы Н2», которые представляют собой металлические сплавы, способные поглощать большие количества Н2, а при каком-либо внешнем воздействии выделять этот Н2 для практического применения (металлогидридные аккумуляторы).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 323; Нарушение авторских прав?; Мы поможем в написании вашей работы!