
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические методы
|
|
|
|
Защита атмосферы (Вопрос 3)
Защита гидросферы (Вопрос 2)
Вводная (Вопрос 1)
Лекции
Экология – наука о взаимоотношении живых организмов с неживой средой их обитания.
Биосфера – наружная оболочка Земли, включающая в себя область распространения жизни, т.е. все живые организмы и неживую среду их обитания.
3 типа вещества в биосфере:
- косное (неживое)
- биокосное (возникшие из неживого)
- живое
Факторы окружающей среды: биотические (живой природы) и абиотические (неживой природы).
Фотосинтез – это синтез органических веществ из неорганических, осуществляемый при участии пигмента хлорофилла и сопровождается поглощение энергии солнечного УФ и выделением молекулярного кислорода. nCO2 + mH2O à Cn(H2O)m + nO2
2 типа питания живых организмов: Автотрофное (самостоятельное, основывается на потребление неорганических веществ, различают а) хемоавтотрофы – синтезируют органические вещества из неорганических, используя энергию которая выделяется при химических реакциях; б) фотоавтотрофы – синтезируют органические вещества из неорганических, используя энергию солнечного УФ) и Гетеротрофное (основано на потреблении органических веществ, различают: а) консументы – потребители; б) детритофаги – используют в пищу органическое вещество отходов и трупов; в) редуценты – разлагают компоненты гумуса до биогенных неорганических веществ).
Экосистема – единый природный комплекс, в котором живые и косные компоненты связаны между собой обменов веществ и энергией.
Классификация экосистем:
- глобальные (биосфера, мировой океан)
- мезоэкосистемы (лесной массив, пруд)
- микроэкосистемы (пень с редуцентами)
Ноосфера – это земное планетарное и космическое пространство, которое создается и управляется человеком.
Глобальные проблемы экологии:
- Изменение состава атмосферы и климата планеты
- Загрязнение гидросферы
- Загрязнение литосферы и почвы
- Изменение биоты
- Проблемы связанные с производством электроэнергии
- Проблемы связанные с развитием транспорта
- Урбанизация (рост населенных пунктов)
- Проблемы в сельском и лесном хозяйствах
Задачи экологии:
- Прогнозирование изменений состава окружающей среды в результате антропогенного воздействия
- Разработка научных концепций охраны окружающей среды и рационального использования природных ресурсов
- Наблюдение за состояние окружающей среды – экологический мониторинг
Классификация систем мониторинга:
- глобальный (наблюдение со спутника)
- национальный (общегосударственный)
- региональный (в пределах региона)
- локальный (в пределах предприятия или рабочего места)
Классификация загрязнений окружающей среды:
- механическое (мусор)
- химическое
- физическое (изм. физических характеристик окр. среды, разделяют: световое, шумовое, тепловое, электромагнитное, радиационное, вибрация)
- биологическое и микробиологическое
ПДК – максимальное содержание вещества, которое не оказывает отрицательное воздействие на человека и окружающую среду в целом. Единицы измерения: для атмосферы [мг/м3]; для гидросферы [мг/л]; для литосферы [мг/кг].
Виды опасности в зависимости от величины ПДК:
1 – черезвычайноопасные
2 – высокоопасные
3 – умеренноопасные
4 – опасные
Гидросфера – водная оболочка Земли, занимающая более 70% поверхности земного шара.
Масса гидросферы: 1,4 * 1018 тонн
94% - вода мирового океана, 4% - подземные воды, 1,6% ледниковые покровы полюсов и горные ледники, 0,4% - поверхностные воды рек, озер, болот и тп.
На долю пресных вод приходится 2,5%, из которых 70% труднодоступно.
Значение гидросферы: она является средой обитания многих живых организмов.
Роль воды в жизни человека: водопотребление (забор воды из водостока) и водопользование (использование водоемов в качестве зон отдыха, транспортных артерий и тп)
Структура водопотребления:
60% промышленность
20% коммунально-бытовое хозяйство
12-13% с/х
и прочее
Загрязняющие вещества водоемов:
Загрязняющие вещества:
1.органические соединения: нефть и нефтепродукты, жиры и масла, фенолы, пестициды, Наиболее опасным является нефть. Ежегодно в мировой океан поступает от 5 до 10 млн тонн нефти, 20% мирового океана покрыто пленкой нефти
2.нефтеорганичесские вещества: нитраты и нитриты, фосфаты, хлориды. Поступают со стоками промышленных предприятий и с атмосферными стоками.
Эвтрофикация – процесс повышения биологической продуктивности водоема в следствии увеличения содержания в нем биогенных веществ
В последствии эвтрофикации является возникновение бескислородных зон бактериальное загрязнение, замещение видов
3.Металлы: железо, магний и алюминий, а также медь, цинк, никель, кадмий, ртуть и т.д. Поступают со стоками промышленных предприятий являющихся протоплазменным.
Причины загрязнения водоемов РФ
1.неудовлетворительное техническое состояние очистных сооружений
2.возростание затрат преувеличение степени чистки сточных вод
Водные ресурсы РФ
1.озера (Байкал 20% пресной воды)
2.водохранилища 5,5 млн га
3.речной сток 530тыс км2
Наиболее загрязненной рекой РФ является Волга
Классификация сточных вод
1.по происхождению:
а) промышленные
б)коммунально-бытовые
в) атмосферные
2.по газово – дисперсионному состоянию
а) взвеси –суспензии и эмульсии
б) коллоидные растворы
Основные показатели качества воды:
1. Кислотность [pH]
2. Жесткость [мг экв/л]
3. Температура [оС]
4. Сухой остаток [мг/л]
5. Цветность [градус цветности]
6. Мутность [мг/л]
7. Прозрачность [см]
8. Растворимый кислород [мг О2/л]
9. Химическое потребление кислорода [мг О2/л]
10. Биохимическое потребление кислорода [мг О2/л]
11. Концентрация примесей [мг/л]
Методы очистки сточных вод:
I. Механические методы. 1) Отстаивание – очистка сточных вод от взвешенных частиц (песка) Осуществляется под действием гравитационных сил в специальных агрегатах различных конструкций.
2) Механическое осаждение. Метод очистки сточных вод от нефтепродуктов и взвешенных частиц, осуществляется под действием центробежных сил в специальных центрифугах.
3) Фильтрование от частиц, нефти с помощью зернистых фильтров или микрофильтров. В зернистых фильтрах в качестве фильтрующих материалов используется: кварцевый песок, дробленый шлак, керамика, галька. Микрофильтры изготовляют из вспененных материалов и используют для очистки воды от нефтепродуктов.
II. Химические методы. 1)Нейтрализация - процесс удаления кислотно-щелочных свойств из сточных вод, осуществляют до рН=7. Кислотные сточные воды нейтрализуют 10% раствором щелочи. Фильтрование через карбонатные фильтры, известняк, мел, мраморная крошка, и т.д.
2) Химическое осаждение – удаление из воды растворенных примесей путем добавления реагентов вступающих с примесями в химическую реакцию с образованием нерастворимых соединений, образуются осадки, их удаляют механическим методом.
Zn2++Ca(OH) 2 → Zn(OH) 2↓+Ca2+
Al3++3KOH → Al(OH) 3↓+3K+
3) Окислительно-восстановительные реакции используются для превращения в менее токсичные или безвредные вещества.
CrO36+ +FeSO4+H2SO4 → Cr23+(SO4)3+Fe23+(SO4)3+H2O
III. Физико-химические методы.
1. Адсорбция – процесс поглощения жидкости или газа твердыми адсорбентами осуществляемый на границе раздела фаз с помощью межмолекулярного взаимодействия. Для очистки сточных вод в качестве в качестве адсорбента, как правило, используют активированный уголь. Адсорбцию используют для очистки воды от фенолов, масел, нефтепродуктов.
2. Метод ионного обмена. Это очистка воды от ионов, с помощью синтетических ионитов. Иониты представляют собой полимерную матрицу, содержащую ионогенные группировки, имеющие по своей структуре подвижные анионы или катионы. При пропускании воды через анионит, происходит обмен анионами между анионитом и водой. При пропускании воды через катионы происходит обмен катионов между катионитом и водой.
3. Экстракция. Процесс перераспределения примеси по системе двух взаимонерастворимых жидкостей – воды и экстрагента, при этом примесь переходит в лучший растворитель (экстрагент), эмульсию разделяют, очищенную воду отправляют на дальнейшую обработку.
Атмосфера (от. др.-греч.— пар и — шар) — газовая оболочка, окружающая планету Земля. Толщина атмосферы — примерно 2000 — 3000 км от поверхности Земли. Суммарная масса воздуха — (5,1—5,3)×1015 тонн.
Строение атмосферы:
- Тропосфера (тропос – изменчивый, образовываются облака, циклоны и антициклоны)
- Стратосфера (стратос - слоистый)
- Мезосфера (мезо - между)
- Термосфера
- Экзосфера (сфера рассеяния).
Загрязняющие вещества: сернистый ангидрит, окись азота, углеводороды, твердые частицы (пыль, зола, сажа).
Специфические выбросы: хлор, молекулярный сероводород, аммиак, фтористые соединения, тяжелые металлы.
Токсические действия основных загрязняющих веществ.
Угарный газ СО: бесцветный газ не раздражает слизистой оболочки глаз и дыхательные пути. При вдыхании взаимодействует с гемоглобином крови, в следствии чего гемоглобин не способен держать кислород, поэтому угарный газ в высоких концентрациях вызывает удушение. Источники поступления: двигатели внутреннего сгорания, металлургические предприятия, котельные.
Сернистый ангидрид SO2: бесцветный газ с резким неприятным запахом, раздражает слизистые оболочки глаз и дыхательных путей. Образуется при сжигании газа и при переработке руд. Существует в атмосфере примерно 4 суток. Источники поступления: ТЭЦ, городские катальные, металлургические предприятия.
Окислы азота NO: образуется при сжигании топлива. Окись азота NO способствует разрушению азотного слоя атмосферы: NO+O3 = NO2+O2 двуокись азота при контакте с влагой образует азотную кислоту, кислотные осадки 2NO2+H2O-HNO3(азотная кислота)+HNO2. Источники поступления: двигатели внутреннего сгорания, ТЭЦ, котельные, металлургические предприятия.
Углеводороды: вызывают головную боль. Возникают при сжигании топлива. Источники: нефтегазовые и нефтехимические предприятия.
Твердые частицы (пыль зола сажа) оказывают механическое воздействие, способные абсорбировать токсичные продукты сгорания.
Источники загрязнения атмосферы подразделяются на стационарные и не стационарные.
Стационарные: промышленные предприятия. Загрязнители промышленности:
1) Металлургическая промышленность. 27% от стационарных источников.
2) Энергетическая промышленность 21% выбросов от стационарных источников
3) Нефтегазовые 12%
4) Нефтехимическая 8%
Нестационарные источники – это транспорт, сжигание топлива населением и прочее. Ежегодно в атмосферу Р.Ф от нестационарных источников поступает более 30 млн. тонн загрязняющих веществ.
Состав автомобильных выбросов: 70% CO (угарный газ), 6% (окислы азота) а также сажа. В Москве выбросы автотранспорта примерно 1 млн. тонн в год, что составляет 90% антропогенных выбросов.
Классификация выбросов в атмосферу по ГОСТу:
- По агрегатному состоянию (твердые, жидкие, газообразные).
- По размерам частиц (<0,5 мкм, от 0,5 до 3 мкм, от 3 до 5 мкм, от 5 до 10 мкм, > 10 мкм)
- По массе (<1кг/ч, от 1кг/ч до 10 кг/ч, от 10 кг/ч до 100 кг/ч)
- По температуре (нагретые, холодные)
- По высоте источника (низкие < 20 метров, от 20-40 метров – промежуточное, высшее > 40 метров)
- По организации отвода и контроля (это организованные через трубы, вентиляции, шахты, фонари. И неорганизационные в результате аварий, разгерметизаций)
- По происхождению (первичные т.е. поступающие непосредственно от тех или иных источников. Или вторичные являющиеся продуктом образования первичных выбросов)
- Технологические.
Методы очистки выбросов в атмосферу.
Очистка выбросов от пыли. Используют сухие и мокрые методы.
I. Сухие методы. Циклоны пылеуловители.
Схема цилиндрического пылеуловителя. Загрязненный воздух передается через входной патрубок (1) в направлении по касательной к стенке (2). Далее он совершает вращательно-поступательные движение вдоль корпуса; частицы пыли отбрасываются к стенкам циклона и затем падают вниз в пыле сборник (3), откуда периодически удаляются. Поток воздуха разворачивается на 180 градусов и выходит в выхлопную трубу (4) Используются «циклоны» для предварительной чистки от крупной пыли.
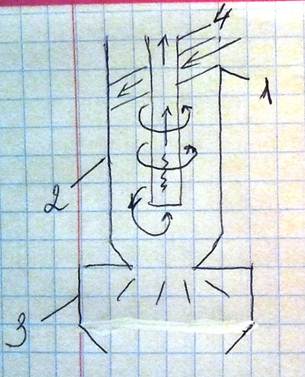
Электрофильтры. Принцип работы основан на основе ионизации пылегазового потока у поверхности координирующих электродов. Приобретая отрицательный заряд, пылинки движутся к осадительному электроду, имеющему знак, обратный заряду координирующего электрода. При встряхивании электродов осажденные частички пыли под действием силы тяжести падают вниз в сборник пыли.
Сухие фильтры – представляют собой герметичную камеру с перегородкой из фильтрующего материала.
Разновидности сухих фильтров:
1) зернистые фильтры (галька, керамзит шлак) Используют для предварительной очистки сильнозагрязненного воздуха.
2) фильтры с гибкими пористыми перегородками (хлопчатобумажные, лавсановые, нейлоновые ткани) Используют для тонкой очистки воздуха.
3) фильтры с полужесткими пористыми перегородками (металлические сетки) Используют при повышенных температурах.
II. Мокрые фильтры. Основаны на связи пыли с жидкостью (турбулентные аппараты, скрубберы)
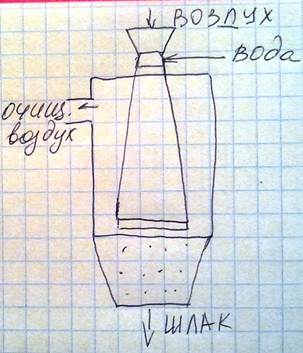
Схема скруббера Вентури. Внутри корпуса скруббера имеется расширяющаяся к низу труба – Вентури. Загрязненный воздух и вода подаются в самую узкую часть трубы. Связывание пыли осуществляется за счет сил инерции и броуновского движения. Высокая степень очистки (95,99%).
Очистка воздуха от токсичных газов и паров.
1) Сорбционные методы. Сорбция – процесс поглощения одного вещества (сорбита) другим веществом (сорбентом). Сорбция обратимый процесс при определенных условиях, если осуществляется десорбция – удаление поглощенного вещества из сорбента. Процесс сорбции сопровождается химической реакцией и является не обратимым, называется хемосорбцией.
АБсорбция – процесс поглощения вредных газообразных примесей жидким поглотителем (абсорбентом: вода, растворы щелочей/соды/аммиака) Осуществляется абсорбционных колоннах различных конструкций, а также скрубберах.
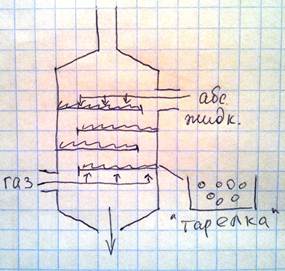
Схема абсорбционной колонны, насадочной конструкции. Внутри колонны имеются секции заполненные элементами насадок керамическими или стеклянными кольцами и т.д. Высокая эффективность очистки обеспечивается расширением абсорбирующей жидкости по элементам насадки и увеличением поверхности контакта между жидкостью связывающее загрязняющее вещество с воздухом. Для увеличения степени поглощения газов, в абсорбирующую жидкость добавляют реагенты, вступающие с поглощенным газом в химическую реакцию. Так осуществляется процесс хемосорбции, являющийся необратимым.
SO2+NaOH → Na2SO3+H2O сульфид натрия
2NH3+H2SO4 → (NH4)2SO4 карбонат натрия
АДсорбция – процесс поглощения жидкости или газа ТВЕРДЫМ адсорбентом, осуществляемый на границе раздела фаз. Адсорбенты – активированный уголь, окись алюминия и др. Адсорбцию осуществляют в адсорбтных колоннах различных конструкций – периодическим или непрерывным методом. Адсорбцию используют для очистки воздуха от паров органических растворителей токсичных и радиоактивных газов – это рекуперационный (??) метод, позволяющий выделить загрязняющее вещество с поверхности адсорбента и повторно его использовать.
Рассмотрим стадии адсорбции на примере рекуперации толуола:
1) Адсорбция – поглощение толуола активированным углем до насыщения адсорбента
2)Десорбция – удаление толуола из адсорбента путем обработки адсорбента перегретым водяным паром.
3)Сушка адсорбента.
4)Охлаждение адсорбента.
Дожигание
Это — высокоэффективный метод, используется для очистки воздуха от паров органических расстворителей и CO.
Может осуществляться открытым способом (в факелах сгорания) при температуре 1100-1300 градусов.
Недостаток метода — образование вторичных загрязнений — окислов азота.
Так же дожигание проводят в камерах сгорания. Воздух сначала подается в камеру предворительного воспламенения и далее в камеру сгорания, где при температуре 1100 градусов без катализатора или 300-600 градусов с присутствием катализатора происходит окисление примесей до углекислого газа и воды.
Очистка воздуха от окислов азота.
Используется некаталитическое гамогенное восстановление при температуре 970+-50 градусов, или каталитическое гетерогенное восстановление при температуре 450+-50 градусов:
2NO+2 + 2NH2+3 + ½ O2 à 2N2+ + 3H2O
Очистка выбросов от сернистого ангидрида.
Загрязненный воздух подается в реактор, в котором при температуре 390 градусов происходит хемосорбция сернистого ангидрида (SO2) твердым оксидом меди, с образованием медного купороса
SO2 + CuO + ½ O2 à CuSO4
2NO + 2NH3 + ½ O2 à 2N2 + 3H2O
Далее осуществляют регенерацию адсорбента, восстанавливая медь молекулярным водородом и окисляя затем кислородом.
CuSO4 + 2H2 à Cu + SO2 + 2H2O
Cu + ½ O2 à CuO
Выделяющийся при этом сернистый ангидрид окисляют до серного ангдрида, который используют для получения серной кислоты.
SO2 + ½ O2 à SO3
SO3 + H2O à H2SO4
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 360; Нарушение авторских прав?; Мы поможем в написании вашей работы!