
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Составление уравнений окислительно-восстановительных реакций. Классификация окислительно-восстановительных реакций
|
|
|
|
Классификация окислительно-восстановительных реакций
1. Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
S + O2 = S + 4O2
S – восстановитель; O2 – окислитель.
Частным случаем являются реакции конпропорционирования (окислителем и восстановителем является один элемент, атомы которого находятся в разных молекулах):
2KMnO4 + 3MnSO4 + 4Н2SO4 = 5MnO2 + 3KНSO4 + 2H2O
Mn+7 – окислитель, Mn+2 – восстановитель.
2. Внутримолекулярные окислительно-восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
2KClO3 = 2KCl + 3O2
Cl+5 – окислитель; О-2 – восстановитель
Частным случаем являются реакции д испропорционирования – это окислительно-восстановительные реакции, в которых один и тот же элемент одновременно повышает и понижает степень окисления.
Cl2 + 2KOH = KClO + KCl + H2O
Cl2 – окислитель и восстановитель
При составлении уравнений окислительно-восстановительных реакций пользуются методом электронного балланса. Электронный баланс – метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданных восстановителем, равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции:
KMnO4 + HCl = KCl + MnCl2 + Cl2↑ + H2O
2. Проставляют степени окисления над элементами, которые ее изменяют:
KMn+7O4 + HCl-1 = KCl + Mn+2Cl2 + 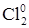 ↑ + H2O
↑ + H2O
3. Определяют число электронов, приобретенных окислителем и отдаваемых восстановителем:
Mn+7 + 5ē → Mn+2
2Clˉ – 2ē → 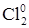 ↑
↑
4. Уравнивают число приобретаемых и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления:

 окисление 2Clˉ – 2ē →
окисление 2Clˉ – 2ē → 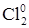 ↑ 5 Clˉ – восстановитель
↑ 5 Clˉ – восстановитель
восстановление Mn+7 + 5ē → Mn+2 2 Mn+7 – окислитель
5. Подбирают коэффициенты для всех остальных участников реакции.
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 302; Нарушение авторских прав?; Мы поможем в написании вашей работы!