
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные показатели пожарной опасности
|
|
|
|
Классификация процессов горения
Цепное самовоспламенение (цепной взрыв)
Тепловое самовоспламенение (тепловой взрыв)
Механизмы возникновения горения
Во всех случаях для процесса горения характерны три стадии:
1. Возникновение горения.
2. Распространение пламени.
3. Погасание пламени (прекращение горения).
Импульс началу реакции горения (воспламенения) горючей смеси дает:
- либо нагрев самой смеси горючего и окислителя (самовоспламенение, самовозгорание);
- либо внешний источник воспламенения: искра, пламя, нагретое тело, ударная волна (зажигание).
Самовоспламенение – это явление резкого увеличения скорости экзотермических реакций, приводящее к самопроизвольному возникновению горения вещества в отсутствии источника зажигания.
Теория теплового самовоспламенения разработана академиком Семе-новым Н.Н., который исходил из представления об ускорении реакций окисления с температурой и преобладания скорости тепловыделения над теплоотводом.
При окислительной реакции, проходящей с полной отдачей образующегося тепла, горение не возникает. Горение возникает лишь в условиях резкого самоускорения химического процесса, связанного с накоплением либо тепла в системе (так называемое тепловое самовоспламенение), либо катализирующих промежуточных продуктов реакции (цепное самовоспламенение). Суть тепловой теории заключается в следующем. Рассмотрим поведение горючей смеси, заключенной в сосуд объемом V с постоянной температурой во всех точках сосуда Т.
В смеси протекает химическая реакция с выделением тепла. Выделившееся тепло расходуется на нагрев смеси и потери в окружающую среду за счет теплопроводности и излучения.
Скорость выделения тепла при реакции:
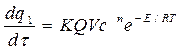 ,
,
где: К – константа скорости реакций, зависящая от температуры;
с – концентрация реагирующих веществ;
n – порядок реакции;
Е – энергия активации реакции;
Q – тепловой эффект реакции;
V – объем сосуда;
τ – время.
Количество тепла, отводимое от поверхности сосуда в единицу времени, выражается линейной зависимостью:
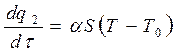
где: α – коэффициент теплоотдачи;
S – площадь поверхности стенок сосуда,
T 0 – температура окружающей среды.
Решающим условием возникновения процесса горения является превышение или равенство скорости выделения тепла реакции над скоростью отдачи тепла реагирующей системой в окружающую среду, например, стенкам реакционного сосуда.
По теории Аррениуса скорость химической реакций определяется числом молекул, обладающей энергией активации. Однако саморазогрев горючей смеси при экзотермической реакции из-за недостаточного теплоотвода (по тепловой теорий самовоспламенения) – не единственно возможный механизм ускорения реакций.
Согласно цепной теории самовоспламенения, химическая реакция самоускоряется не путем непосредственного взаимодействия исходных молекул с выделением тепла, а с помощью активных "осколков" (радикалов, атомарных частиц и др.), образующихся при распаде этих молекул. При этом скорость реакций может прогрессивно возрастать и в изотермических условиях.
Таким образом, причиной самоускорения реакций может быть накопление в системе как тепла реакции, так и химически активных продуктов реакции.
Цепной механизм реакции объясняется перераспределением избыточной энергии, которая реализуется в реакции следующим образом: запас химической энергии, сосредоточенный в молекуле продукта первичной реакции, передается одной из реагирующих молекул, которая переходит в химически активное состояние. Подобные условия более благоприятны для протекания реакции, чем условия, при которых химическая энергия взаимодействия переходит в энергию теплового хаотического движения.
При таком механизме передачи энергии реакция приводит к образованию одной или нескольких новых активных частиц – возбужденных молекул, свободных радикалов или атомов. Таковы, например, атомарный водород, кислород, хлор, радикалы и гидроксил, и т.д. Все эти вещества, являясь химически ненасыщенными, отличаются высокой реакционной способностью и могут реагировать с компонентами смеси, образуя в свою очередь, свободные радикалы и атомы. Так образуется цепочка последовательных реакций.
Цепная реакция протекает различно, в зависимости от того, сколько активных вторичных центров образуется на каждый израсходованный активный центр – один или больше одного. В первом случае общее число активных центров остается неизменным, и реакция протекает с постоянной (при данных температуре иконцентрации) скоростью, т.е. стационарно. Во втором случае число активных центров непрерывно возрастает, цепь разветвляется и реакция самоускоряется.
Это неограниченное, до полного израсходования реагирующих компонентов, самоускорение воспринимается как самовоспламенение. Внешне реакция протекает так же, как и при тепловом самовоспламенении. Различие состоит в том, что при тепловом механизме в реагирующей смеси накапливается тепло, а при цепном механизме – активные центры. Оба фактора ведут к ускорению реакции. Цепное воспламенение принципиально может осуществляться при постоянной температуре без заметного разогрева смеси.
Условием ускорения реакции является в данном случае превышение числа разветвления цепей над числом их обрывов (при образовании конечного продукта, на стенках реакционного сосуда и т.д.). Цепные реакции могут протекать и при полном отводе тепла, т.е. в изотермических условиях, тогда как при тепловом механизме реакция должна была бы затухнуть. По цепной теории появление тепла – только следствие процесса, а не причина возникновения горения.
По разным признакам и особенностям процессы горения можно разделить на следующие виды:
По агрегатному состоянию горючего вещества:
- горение газов;
- горение жидкостей и плавящихся твердых веществ;
- горение неплавящихся твердых пылевидных и компактных веществ.
По фазовому составу компонентов:
- гомогенное горение (реагирующие вещества находятся в одном агрегатном состоянии);
- гетерогенное горение;
По подготовленности горючей смеси:
- диффузионное горение (пожар) (скорость образования горючей смеси ниже скорости химической реакции горения);
- кинетическое горение (взрыв) (образование горючей смеси происходит практически мгновенно – горение газов).
По степени сгорания горючего вещества:
- полное (при достаточном или избыточном количестве окислителя);
- неполное (при недостатке окислителя).
1. Температура вспышки — наименьшая температура горючего вещества, при которой над его поверхностью образуются пары в таком количестве, что они способны вспыхивать при контакте с открытым источником огня; устойчивое горение при этом не возникает. Вспышка — быстрое сгорание газопаровоздушной смеси над поверхностью горючего вещества, сопровождающееся кратковременным видимым свечением. Легковоспламеняющимися называются горючие жидкости с температурой вспышки не более 61 °C.
2. Температура самовоспламенения — наименьшая температура горючего вещества, при нагреве до которой происходит резкое увеличение скорости экзотермических объёмных реакций, приводящее к возникновению пламенного горения. Эта температура требуется для достижения энергии активации реакции горения. Для большинства веществ составляет 700-1000 оС.
3. Температура воспламенения — наименьшая температура вещества, при которой пары над поверхностью горючего вещества выделяются с такой скоростью, что при воздействии на них источника зажигания наблюдается воспламенение. Воспламенение — пламенное горение вещества, инициированное источником зажигания и продолжающееся после его удаления, то есть при температуре воспламенения возникает устойчивое горение.
4. Концентрационная область воспламенения газа, пара или взвеси - интервал концентрации горючего вещества, равномерно распределённого в данной окислительной среде (обычно в воздухе), в пределах которого вещество способно воспламеняться от источника зажигания с последующим распространением самостоятельного горения по смеси. Область воспламенения ограничена нижними и верхними концентрационными пределами воспламенения (НКПВ и ВКПВ). Значения концентрационных пределов воспламенения зависят от рода веществ и окислительной среды, параметров состояния, направления распространения пламени, формы и размера сосуда, в котором заключена смесь.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 636; Нарушение авторских прав?; Мы поможем в написании вашей работы!