
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексонометрическое титрование
|
|
|
|
В аналитической химии широко применяется метод анализа, основанный на использовании реакций, сопровождающихся образованием внутрикомплексных (хелатных) соединений с органическими соединениями - комплексонами. Комплексонами называют аминополикарбоновые кислоты и их производные.
В анализе используют ее динатриевую соль Na2H2L 2Н2О, которая в отличие от кислоты хорошо растворима в воде и находит более широкое применение. 
Комплексоны являются полидентатными лигандами, которые образуют со многими катионами (Са2+, Ва2+, Sr2+, Mg2+, Со2+, Сu2+, Bi3+, Al3+, Zn2+, Fe3+, Ni2+ и др.) очень прочные, хорошо растворимые в воде, бесцветные внутрикомплексные (хелатные) соединения. Внутрикомплексные соли образуются всегда в тех случаях, когда катионы металла - комплексообразователя замещают активные атомы водорода функциональных групп органического соединения, а также с определенными его группами образуют координационные (донорно-акцепторные) связи. К группам, в которых атомы водорода способны замещаться на ионы металла, относятся -СООН, -SО3Н, -ОН, =NOH и др. Донорно-акцепторную связь с ионами комплексообразователя способны образовывать группы -NH2, =NH, -NOH, =S, =СО и др.
Комплексонометрия (трилонометрия) - титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота.
В растворе трилон Б диссоциирует на ионы:
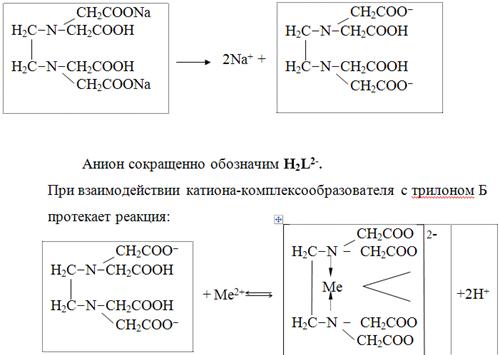
Схематически реакции комплексообразования с катионами, имеющими различные степени окисления, можно представить следующими уравнениями:
H2L2- + Ме2+ ↔ [MeL]2- + 2Н+
H2L2- + Ме3+ ↔ [MeL]- + 2Н+
H2L2- + Ме4+ ↔ [MeL] + 2Н+
Способы фиксирования конечной точки титрования. При комплексонометрическом титровании используют металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы - это органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б, цинкон и др.), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б.
При этом комплекс катиона с индикатором и свободный индикатор имеют различную окраску:
H2Ind- + Ме 2+↔ [Ме Ind]-
(окраска 1) (окраска 2)
При комплексонометрическом титровании к анализируемому раствору прибавляют металлоиндикатор, который образует с определяемыми катионами комплекс, имеющий определенную окраску. В процессе титрования трилоном Б комплекс катионов металла с индикатором разрушается и образуется бесцветный, очень прочный комплекс катионов с трилоном Б, а в раствор переходят ионы свободного индикатора:
[Ме Ind] - + H2L2 - ↔ [MeL]2 - + H2Ind -
(окраска 2) (окраска 1)
Конечную точку титрования определяют по собственной окраске индикатора (окраска 1).
Условия комплексонометрическоro титрования:
1. Реакции комплексообразования должны протекать быстро, количественно и стехиометрично, чтобы вблизи точки эквивалентности определяемые катионы были практически полностью связаны в комплекс. Константа нестойкости образующихся комплексов должна быть малой величиной.
2. Определяемые ионы должны образовывать с металлоиндиктором менее прочные комплексы, чем их комплексы с трилоном Б.
3. Комплексонометрическое титрование следует проводить при определенном значении рН (рН < 10), так как в щелочной среде могут образовываться осадки гидроксидов определяемых катионов или их основные соли.
В процессе титрования при взаимодействии катионов с трилоном Б в раствор переходят ионы Н+, в результате чего рН раствора понижается, что приводит к смешению реакции комплексообразования влево и делает реакцию обратимой. Для поддержания определенного значения рН титрование следует проводить в присутствии буферных растворов, имеющих определенное значение рН. Большинство катионов титруют трилоном Б в присутствии аммиачного буферного раствора NH4ОH + NH4Cl при рН = 9,2.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 673; Нарушение авторских прав?; Мы поможем в написании вашей работы!