
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Орбитальное квантовое число 0 1 2 3 4
|
|
|
|
K L M N O P Q
Квантовые числа
Главное квантовое число (n) определяет энергию и размеры электронных орбиталей, удаленность уровня от ядра. Принимает целые значения (n = 1, 2, 3... до ¥) и соответствует номеру периода. Число n показывает, сколько подуровней имеет каждый уровень, и какой энергетический уровень является внешним. Чем больше n, тем выше энергия. Оболочки (уровни) имеют буквенные обозначения
n = 1 2 3 4 5 6 7
Пример. Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Орбитальное (побочное или азимутальное (l)) квантовое число определяет форму атомной орбитали и характеризует энергетические подуровни. Величина l принимает целочисленные значения от 0 до (n – 1) и может обозначаться буквами.
Подоболочка (подуровень) s р d f g
Каждому значению l соответствует орбиталь особой формы, например s-орбиталь имеет сферическую форму, р-орбиталь – гантель.
В одной и той же оболочке энергия подуровней возрастает в ряду Es < Ep < Ed < Ef < Eg. В первой оболочке (n = 1) может быть одна s-; во второй (n = 2) две s- и р-, в третьей (n = 3) s-, р- и d-, в четвертой (n = 4) s-, р-, d- и f- подоболочки и т. д.
Магнитное квантовое число (ml) характеризует ориентацию орбиталей в пространстве относительно внешнего магнитного или электрического поля и их максимального количества для подуровней. В отсутствие внешнего магнитного поля все орбитали одного подуровня имеют одинаковое значение энергии. Величина ml принимает целочисленные значения от –l до +l, включая ноль, и меняется скачкообразно. Это означает, что для каждой формы орбитали существует (2l + 1), энергетически равноценных ориентации в пространстве.
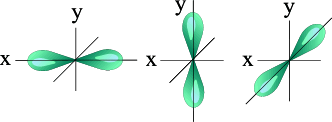
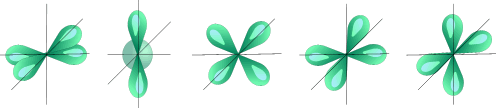
Так при l = 0 ml = 0 – это s-подоболочка, имеющая одну орбиталь шарообразной формы; при l = 1 ml = -1; 0; +1 – это p-подоболочка, имеющая три оболочки гантелеобразной формы (рис. 1); при l = 2 ml = -2; -1; 0; +1; +2 – это d-подоболочка, имеющая пять орбиталей сложной конфигурации, а при l = 3 ml = -3; -2; -1; 0; +1; +2; +3 это f-подоболочка, имеющая семь орбиталей сложной конфигурации. Таким образом, на s-подуровне – одна, на p-подуровне – три, на d- подуровне – пять, на f-подуровне – 7 орбиталей.
Спиновое квантовое число (ms) характеризует механический момент движения электронов и имеет два значения +1/2 и –1/2, соответствующие противоположным направлениям вращения. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками ↑ ↓. Каждая электронная орбиталь в атоме (или атомная орбиталь (АО)) характеризуется тремя квантовыми числами: n, l и ml. Общие число атомных орбиталей в оболочках равно n2. Условно атомную орбиталь обозначают в виде клеточки. Состояние электрона в атоме полностью характеризуется четырьмя квантовыми числами n, l, ml, и ms.
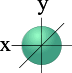
| 
|
| S - орбиталь | Три p – орбитали |
|
| Пять d – орбиталей |
Рис. 1. Формы электронных облаков
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 900; Нарушение авторских прав?; Мы поможем в написании вашей работы!