
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соли диазония
|
|
|
|
Образуются при взаимодействии ароматических аминов с азотистой кислотой в кислой среде. Эта реакция называется реакцией диазотирования:
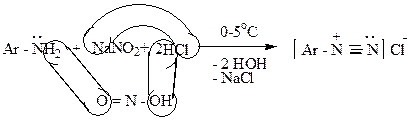 |
Для получения азотистой кислоты можно использовать:
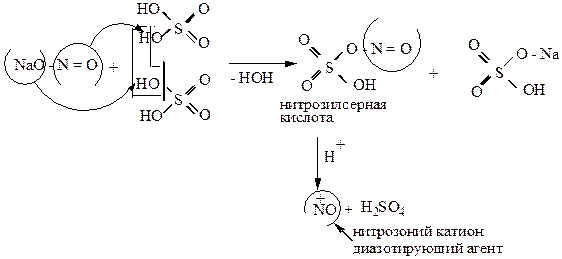 а) Н2SO4 конц.
а) Н2SO4 конц.
Нитрит сернокислый
Натрия кислый натрий
серная
кислота
б) Н2SO4 средней конц.
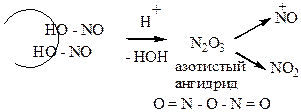 |
NaNO2 + H2SO4 = HNO2 + NaHSO4
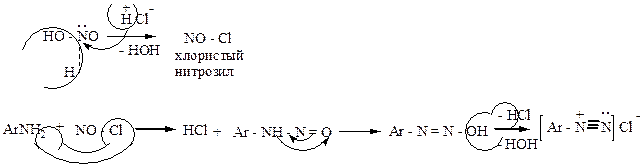 |
в) HCl или HBr
NaNO2 + HCl = HNO2 + NaCl
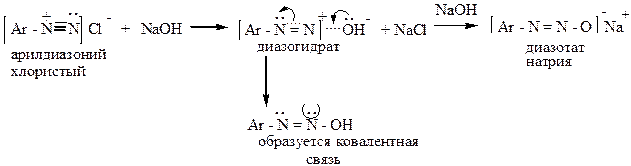 |
г) щелочная среда
в щелочной среде соли диазония образуют гидрат диазония:
 |
Диазотаты, диазоцианиды и другие подобные вещества с группировкой – N = N – могут существовать в двух формах – син- и анти-:
Побочные реакции диазотирования:
а) в нейтральной или слабокислой среде
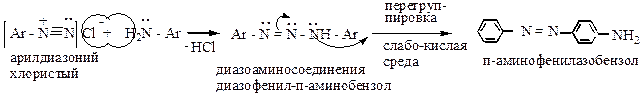 |
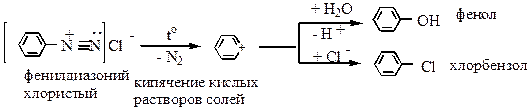 |
б) несоблюдение температурных условий
Реакции солей диазония могут проходить:
I - с выделением азота
II - без выделения азота
 |
I - с выделением азота
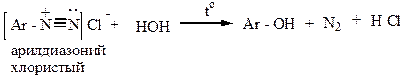
1) Нагревание слей диазония в отсутствие растворимых солей:
2) При действии иодида калия получают арилиодиды (арилхлориды и арилбромиды в этих условиях не образуются):
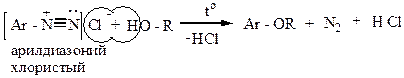
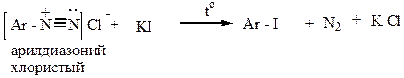 |
3)
4) Замещение диазогруппы на другие атомы или группы атомов происходит в присутствие соответствующих солей меди или медного порошка: (реакция Зандмейера):
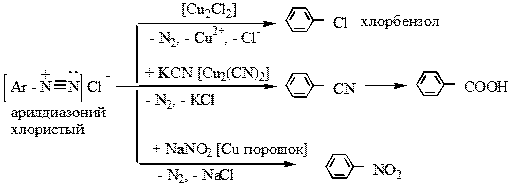 |
5) Александр Николаевич Несмеянов разработал метод получения металлоорганических соединений (ртутноорганических):
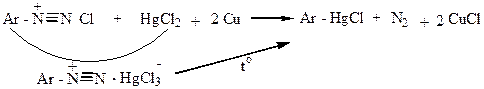 |
II – без выделения азота (амфотерные свойства)
1)
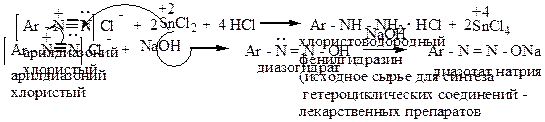 |
2) реакция восстановления в фенилгидразин
восстановление солями сернистой кислоты (промышленный способ):
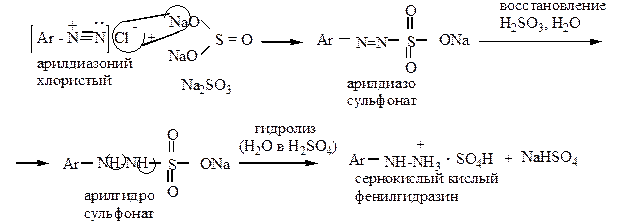 |
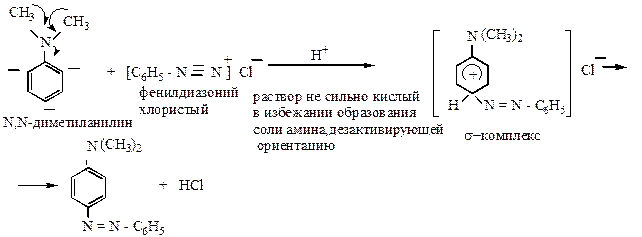 |
3) реакции азосочетания – это реакции электрофильного замещения в ядре фенол (нафтола) или ароматического амина.
В s-комплексе один атом углерода пребывает в состоянии sp3 -гибридизации, а второй (формально лишившийся p-связи) приобретает вакантную орбиталь (+). Сопряжение последней с оставшимися четырьмя p-электронами приводит к делокализации и, следовательно, стабилизации положительного заряда. Образовавшийся таким образом циклогексадиенильный катион отщепляет протон (от атома углерода в sp3 -состоянии) и снова превращается в устойчивую ароматическую систему.
Замещение идет в п -положение, и если оно занято, то в о -положение.
При замещении в п -положение возникает более длинная цепь сопряжения в продукте реакции, и оно является более устойчивым.
Электофильным реагентом является диазокатион. Другие формы диазосоединений в этой реакции не участвуют.
В случае первичных и вторичных ароматических аминов в слабокислой среде азогруппа идет не в ядро, а в аминогруппу:
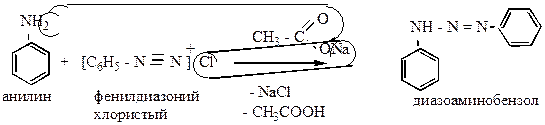 |
Реакция широко используется в технике для приготовления азокрасителей.
Процесс состоит из
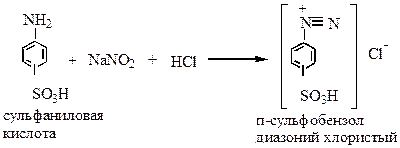 |
а) диазотирования – взаимодействие аминов с азотистой кислотой в кислой среде с образованием активного реагента диазокатиона:
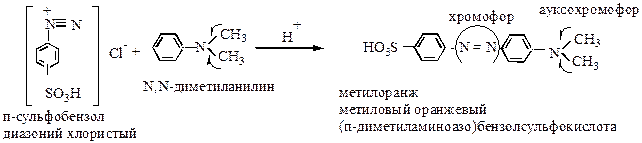 |
б) азосоченание
13 Азосоединения
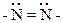 |
Это соединения содержащие азогруппу (), которая соединена с двумя углеводородными радикалами.
В зависимости от природы радикала:
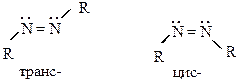 - азоалканы
- азоалканы
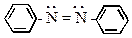 - азоарены
- азоарены
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1744; Нарушение авторских прав?; Мы поможем в написании вашей работы!