
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод Мора - NaCl, KCl, NaBr, KBr - ГФ X
|
|
|
|
Количественное определение галогенидов
Точную навеску препарата растворяют в воде и титруют 0,1М AgNO3 с индикатором K2CrO4 при pH=6-8 до оранжево-желтого окрашивания.
NaBr + AgNO3 à NaNO3 + AgBr¯
КТТ: K2CrO4 + 2AgNO3 à KNO3 + Ag2CrO4¯ кирпично-красный.
Ограничения: в кислой среде CrO42- à Cr2O72- и обр. осадок Ag2Cr2O7¯ другого цвета. Метод пригоден только для бесцветных растворов. Метод не используется для I-, т.к. AgI¯ образует коллоидный раствор, затрудняющий осаждение в точке эквивалентноси, мешают SO42-, S2-, PO43-, AsO43-, BO33-, взаимодействующие с Ag+ с образованием осадков. Мешают также Hg2+, Pb2+, Ba2+, из-за образования осадков с индикатором.
Среда для титрования нейтральная или слабощелочная, т.к. в сильнощелочной среде выпадает черный осадок:
Ag+ + OH- à AgOH à Ag2O¯
f(NaBr)=1; 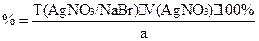
Метод Фаянса – KI, NaI (ГФ X)
Точную навеску препарата предварительно высушивают при 110 С, растворяют в 30 мл воды, прибавляют 1,5 мл. CH3COOH, 5 капель раствора эозината натрия и титруют 0,1M AgNO3 до перехода окраски от желтой до розовой. рН – слабокислая (CH3COOH). Индикатор – адсорбционный (эозинат натрия – рис, [Ind2-](Na+)2)
KI + AgNO3 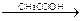 AgI¯ + KNO3
AgI¯ + KNO3
Избыток Ag: AgI¯ 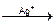 [AgI•Ag]+
[AgI•Ag]+ 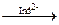 перезарядка [AgI•Ag]2Ind↓ розовое окрашивание
перезарядка [AgI•Ag]2Ind↓ розовое окрашивание
Частица индикатора связывает 2 коллоидные частицы [AgI•Ag]+, происходит коагуляция.
f(KI)=1; 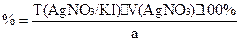
Индикатор – соль органической кислоты, диссоциирует в растворе. В присутствии минеральных кислот диссоциации и окрашивания нет.
Можно также определять Cl, Br (НЕ ГФ)
Навеску растворяют + бромфеноловый синий + CH3COOH до зеленоватого цвета, титруют до фиолетового окрашивания.
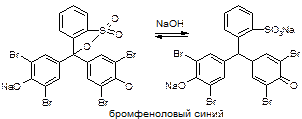
Метод Фольгарда – Br, I, (Сl)
Обратное титрование. Титрант – 0,1M AgNO3, Ind – FeNH4(SO4)2 (железоаммонийные квасцы); pH=3 (HNO3). Избыток AgNO3 оттитровывают NH4SCN.
KBr + AgNO3 точн. избыток 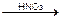 AgBr¯ + KNO3
AgBr¯ + KNO3
избыток AgNO3 + NH4SCN 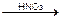 AgSCN¯ + NH4NO3
AgSCN¯ + NH4NO3
КТТ: 3NH4SCN + FeNH4(SO4)2 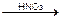 Fe(SCN)3¯ + 2(NH4)2SO4 (бурое окрашивание)
Fe(SCN)3¯ + 2(NH4)2SO4 (бурое окрашивание)
Преимущества: можно титровать в кислой среде, не мешают ионы.
Недостатки: меньше точности, для Cl - очень осторожно, т.к. ПР(AgCl) > ПР(AgSCN), AgCl будет растворяться и превращаться в AgSCN. Добавляют органический растворитель, экранирующий AgCl.
При определении I-, Fe3+ индикатора – окислитель. I- à I2, поэтому индикатор добавляют в последний момент.
f(KBr)=1; 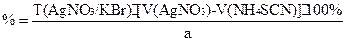
Метод Кальтгоффа-Стенгера – Br-
Титранты – 0,1M AgNO3; 0,1M NH4SCN, обратное титрование. Титруют до розового окрашивания. Отличае от метода Фольгарда в порядке добавления титрантов. Индикатор – железоаммонийные квасцы FeNH4(SO4)2
3NH4SCN точн. избыток + FeNH4(SO4)2 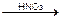 Fe(SCN)3¯ бурый + 2(NH4)SO4
Fe(SCN)3¯ бурый + 2(NH4)SO4
Титруют: KBr + AgNO3 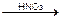 AgBr¯ + KNO3
AgBr¯ + KNO3
AgNO3 + NH4SCN 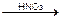 AgSCN¯ + NH4NO3
AgSCN¯ + NH4NO3
КТТ: Fe(SCN)3 + 3AgNO3 à 3AgSCN¯ + Fe(NO3)3
f(KBr)=1; 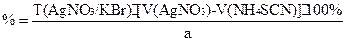
Преимущества: мало расходуется нитрат серебра. Используют для определения бромкамфоры после минерализации.
Метод Кальтгоффа – I- в присутствии Cl, Br – йодкрахмальный метод
Раствор препарата + 1 капля KIO3 + раствор крахмала и H2SO4 разв. до появления синего окрашивания.
KIO3 + 5KI + 3H2SO4  3I2 + 3K2SO4 + 3H2O
3I2 + 3K2SO4 + 3H2O
Титруют AgNO3 до исчезновения синего окрашивания.
KI + AgNO3 à AgI¯ + KNO3
f(KI)=1; 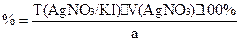
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1607; Нарушение авторских прав?; Мы поможем в написании вашей работы!