
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеси в препаратах галогенидов
|
|
|
|
Аргентометрия с внешним индикатором
Индикатор – нитрит-крахмальная бумага. Титруют AgNO3 в присутствии H2SO4.
Рассчитывают теоретический объем титранта (AgNO3) и около точки эквивалентности каждый раз при добавлении титранта переносят каплю раствора на индикатор. Если нет синего окрашивания – конец титрования.
KI + AgNO3 à KNO3 + AgI
KI + NaNO2 + H2SO4  I2 + NO + Na2SO4 + K2SO4
I2 + NO + Na2SO4 + K2SO4
f=1; 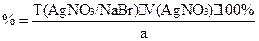
Недостатки: потери при выносе капли, приблизительные расчеты объема титранта.
Барий, кальций и броматы определяют за одно испытание, прибавляя 1 мл H2SO4, раствор должен быть прозрачным и не должен окрашиваться в желтый цвет в течении 5 минут.
Ba2+ + H2SO4к à BaSO4¯
Ca2+ + H2SO4к à CaSO4¯
5Br- + BrO3- + 3H2SO4 à 3Br2 + SO42- + 3H2O
Примесь йодатов, тиосульфатов и сульфитов. Приб. несколько капель крахмала и разв. H2SO4. Жидкость не должна приобретать в течение 30 секунд заметного синего окрашивания.
5KI + KIO3 + 3H2SO4 à 3I2 + K2SO4 + 3H2O
Синее окрашивание должно появиться при прибавлении не более одной капли 0,1 М I2.
2Na2S2O3 + I2 à 2NaI + Na2S4O6
Na2SO3 + I2 + H2O à Na2SO4 + 2HI
Примесь цианидов определяют, добавляя FeSO4, FeCl3. Подщелачивают, слегка нагревают, после подкисления раствор не должен окрашиваться в синий цвет (берлинская лазурь).
2CN- + FeSO4 à Fe(CN)2 + SO42-
4CN- + Fe(CN)2 à [Fe(CN)6]4-
K4[Fe(CN)6] + FeCl3 à KFe[Fe(CN)6]- + 3KCl
Примесь йодидов определяют, добавляя 3 капли FeCl3 и несколько капель крахмала. В течение 10 мин. не должно быть синего окрашивания.
2I- + 2FeCl3  I2 + 2FeCl2 + 2Cl-
I2 + 2FeCl2 + 2Cl-
Примесь нитратов определяют, добавляя NaOH и цинковые или железные опилки. Нагревают. Влажная красная лакмусовая бумажка в парах жидкости не должна синеть.
Zn + NaOH  Na2ZnO2 + H2 NaNO3 + H2 à NH3 + NaOH + 2H2O
Na2ZnO2 + H2 NaNO3 + H2 à NH3 + NaOH + 2H2O
Препараты:
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 491; Нарушение авторских прав?; Мы поможем в написании вашей работы!