
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип работы индикатора
|
|
|
|
До начала титрования индикатор образует характерно окрашенный комплекс с катионом металла.
По мере титрования свободные катионы металла связываются уже с титрантом – трилоном Б. Причем комплекс металла с трилоном Б более прочный, чем с индикатором, поэтому когда мы связываем все свободные катионы, начинает разрушаться первоначальный комплекс, окраска меняется на свойственную свободному индикатору.
Трилон Б связывается с катионами металла, имеющими заряд от 2 до 4, и в любом случае фактор равен единице (при необходимости распадается ионная связь с атомами натрия).
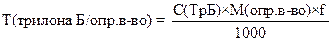
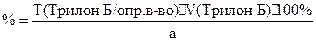
Препараты:
Magnesii sulfas - магния сульфат – MgSO4•7H2O
Получение:
1) Из магнезита:
MgCO3 + H2SO4 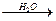 MgSO4•7H2O + CO2
MgSO4•7H2O + CO2
2) Из даламита (MgCO3•CaCO3), амарита.
Описание: Бесцветные, прозрачные кристаллы, выветривающиеся на воздухе.
Растворимость: растворим в 1 части воды, 0,3 ч кипящей воды, практически не растворим в 95% спирте.
Подлинность:
Mg2+ + Na2HPO4 + NH4OH + 5H2O 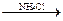 MgNH4PO4•6H2O¯ + 2Na+
MgNH4PO4•6H2O¯ + 2Na+
Белый крист., растворим в уксусной и минеральных кислотах
SO42- + BaCl2 àBaSO4¯
Осадок нерастворим в минеральных кислотах.
Допустимые примеси: хлориды, тяжелые металлы, железо, мышьяк.
Марганец: препарат растворяют в воде, прибавляют к. H2SO4, небольшое количество 0,1 M раствора AgNO3, греют до закипания, прибавляют персульфат аммония, еще раз греют до закипания. Параллельно проводим контрольный опыт (бесцветный) и титруем его раствором перманганата калия до уравнения окрасок, рассчитываем содержание марганца (не более 0,004%). Препарат, применяемый для инъекций не должен содержать марганца (не должно быть розовой окраски).
Mn2+ + (NH4)2S2O8 + H2O 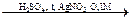 MnO4-+ 2SO42- + 2NH4+
MnO4-+ 2SO42- + 2NH4+
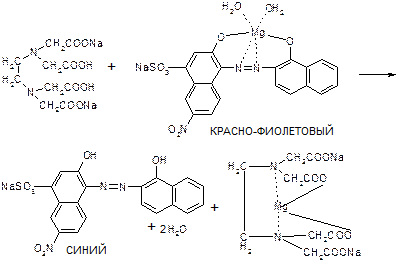
Количественное определение: Прямая комплексонометрия в среде аммиачного буфера с рН 9,5-10,0. Индикатор эриохром черный Т. Титруют раствором трилона Б (0,05 моль/л) до синего окрашивания.
Добавляем индикатор:
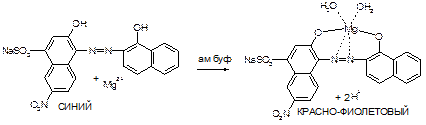
Титруем трилоном Б:
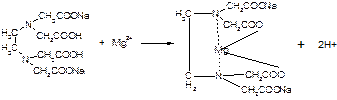
КТТ:
Вещества в препарате должно быть не менее 99,0% и не более 102,0%.
Хранение: в хорошо упакованной таре
Применение: успокаивающее, спазмолитическое, слабительное, желчегонное.
Magnesii oxydum (magnesia usta) – магния окись (магнезия жженая) - MgO
Описание: белый мелкий легкий порошок без запаха
Растворимость: практически нерастворим в воде, свободной от СО2, и в спирте. Растворим в разведенной HCl, H2SO4 и уксусной.
Подлинность: -
Допустимые примеси: хлориды, сульфаты, кальций, тяжелые металлы, мышьяк, карбонаты щелочных металлов, растворимые соли.
Количественное определение: растворяют в HCl, нейтрализуют NH4OH, далее как MgSO4.
Хранение: в хорошо упакованной таре.
Применение: антацидное средство.
Magnesii subcarbonas (magnesia alba) – магния карбонат основной (магнезия белая)
Описание: белый легкий порошок без запаха.
Растворимость. Практически нерастворим в воде, свободной от СО2, и в спирте. Растворим в разведенных минеральных кислотах, тр. р-рим в уксусной кислоте, легко в кипящем уксусе.
Подлинность:
Реакции на магний смотри Магния сульфат. На карбонат-ион:
CO32- + 2H+ à CO2 + H2O
Выделяются пузырьки газа под действием минеральных кислоты.
Допустимые примеси: хлориды, тяж. металлы, железо, мышьяк, карбонаты щелочных металлов, растворимые соли.
Недопустимые примеси: сульфаты, кальций, барий.
Количественное определение: см. Магния сульфат.
Хранение: в хорошо упакованной таре.
Применение: вяжущее и антацидное
Barii sulfas pro roentgeno – бария сульфат для рентгеноскопии – BaSO4
Получение: Руды "барит" (BaSO4), "витерит" (Ba(OH)2). Их надо очистить:
BaSO4 + 4C à BaS + 5CO
BaS + 4HCl à BaCl2 + H2S
Получается растворимая соль бария, ее, соответственно, растворяют, фильтруют, добавляют сульфат в избытке, - выпадает BaSO4¯.
Описание: белый, тонкий рыхлый порошок без запаха.
Растворимость: НР в воде, в растворах кислот и щелочей, органических растворителях.
Подлинность:
BaSO4 + Na2CO3 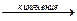 BaCO3¯ + Na2SO4
BaCO3¯ + Na2SO4
Осадок фильтруют, в фильтрате после удаления CO2 доказывают наличие сульфат-ионов.
Na2CO3 + 2HCl à 2NaCl + CO2
SO42- + Ba2+ à BaSO4¯
Осадок на фильтре обрабатывают HCl.
BaCO3 + 2HCl à BaCl2 + CO2 + H2O
Ba2+ + H2SO4 à BaSO4¯ + 2H+
Доброкачественность:
Недопустимые примеси. Сульфиды. Добавляют HCl, кипятят, над колбой бумажка с ацетатом свинца. Не должно быть потемнения бумажки.
Растворимые соли бария. Кипятят в присутствии ледяной уксусной кислоты, фильтруют, растворяют в воде. К прозрачному фильтрату добавляют 3-4 капли р.H2SO4. В течении часа не должно быть помутнения. Реакции водной вытяжки должна быть нейтральной.
Восстанавливающие вещества. Добавляют р. H2SO4, KMnO4 – не должно быть обесцвечивания.
MnO4- + 6e + 8H+ à Mn2+ + 4H2O
Хлориды, сульфаты, фосфаты.
Допустимые примеси: железо, мышьяк.
Определение степени дисперсности: готовят суспензию в воде определенного объема, взбалтывают, оставляют стоять. Смотрят границу выпадения осадка; эта граница не должна опускаться ниже определенного предела.
Количественное определение: в ФС нет.
Катион-обменная хроматография:
BaSO4 + [катионит]H+ à H2SO4 + [катионит]Ba2+
Полученный раствор титруют NaOH в присутствии фенолфталеина.
Хранение: в хорошо укупоренной таре в заводской упаковке. Пакеты – двойные, бумажные, внутренний из пергамента, эти пакеты не должные храниться вблизи CO32-.
Применение: рентгеноскопия ЖКТ в виде водной суспензии.
Calcii chloridum – кальция хлорид – CaCl2•6H2O
Получение: из мела, мрамора, известняка, предварительно очищенных от железа и магния:
CaCO3 + 2HCl à CaCl2•6H2O + CO2
Описание: бесцветные кристаллы без запаха. Очень гигроскопичны, на воздухе расплывается.
Растворимость: очень легко растворим в воде, вызывает при этом сильное охлаждение раствора, легко растворим в 95% спирте.
Подлинность: Кальций.
Ca2+ + C2O4(NH4)2 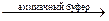 CaC2O4 + 2NH4+
CaC2O4 + 2NH4+
Осадок растворим в минеральных кислотах, нерастворим в аммиаке и уксусе.
CaC2O4 + HCl à CaCl2 + H2C2O4
Ca2+ Окрашивает пламя в кирпично-красный.
Хлор:
Cl- + AgNO3 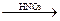 AgCl¯ + NO3-
AgCl¯ + NO3-
Выпадает белый аморфный осадок, растворим в аммиаке
AgCl + 2NH4OH à [Ag(NH3)2]Cl + 2H2O
Допустимые примеси: сульфаты, тяжелые металлы, железо, мышьяк, магний, щелочные металлы.
Недопустимые примеси: барий, алюминий, фосфаты, цинк.
Количественное определение: Прибавляют 10 мл буферного раствора с рН 9,5-10,0; индикаторной смеси или 7 капель раствора индикатора хромового темно - синего и титруют раствором трилона Б (0,05 моль/л) до сине - фиолетового окрашивания
Первая стадия:
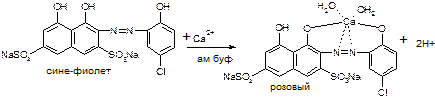
Вторая и третья стадии аналогично Магния Сульфату.
Хранение: в небольших хорошо упакованы стеклянных банках с пробками, залитыми парафином в сухом месте
Применение: источник иона Ca, антиаллергическое средство, противовоспалительное, кровоостанавливающее, диуретическое.
Zinci sulfas – цинка сульфат – ZnSO4•7H2O
Описание: бесцветные прозрачные кристаллы или мелкокристаллический порошок без запаха. На воздухе выветривается, водный раствор имеет кислую реакцию.
Растворимость: очень легко растворим в воде, практически нерастворим в спирте. Растворим в 10 частях глицерина.
Подлинность:
1) При взаимодействии с сульфидом натрия выпадает белый осадок, нерастворим в уксусной кислоте (р), легко растворим в НСl.
Zn2+ + Na2S à ZnS¯ + 2Na+
ZnS + HCl à ZnCl2 + H2S
2) С гексацианоферратом калия дает белый аморфный студенистый осадок, нерастворимый в HCl.
Zn2+ + K4[Fe(CN)6] à K2Zn[Fe(CN)6]¯ + 2K+
3Zn2+ + 2K4[Fe(CN)6] à K2Zn3[Fe(CN)6]2¯ + 6K+
3) Сульфат с солью бария дает белый осадок, нерастворимый в минер. кислотах
SO42- + Ba2+ à BaSO4
Допустимые примеси: хлориды, мышьяк.
Недопустимые примеси: нитраты, алюминий, железо, медь, магний, кальций.
Количественное определение: Прямая комплексонометрия. Титрант: трилон Б, pH=9,5-10. Инд – кислотный хром черный специальный.
Хранение: Список Б. В хорошо упакованной таре.
Применение: Антисептик и вяжущее.
Zinci oxydum – окись цинка – ZnO
Описание: белый или белый с желтоватым оттенком аморфный порошок без запаха. Поглощает СО2 воздуха.
ZnO + CO2 à ZnCO3
Растворимость: практически нерастворим в воде и спирте, растворим в растворах щелочей, разв. минеральных кислотах, уксусной кислоте.
Подлинность: при прокаливании окрашивается в желтый цвет., при охлаждении снова белеет.
Допустимые примеси: мышьяк.
Недопустимые примеси: карбонаты и нер-мые примеси железа, меди, алюминия, свинца.
Количественное определение: Прямая комплексонометрия после растворения в соляной кислоте и нейтрализации раствором аммиака. Титрант: трилон Б, pH=9,5-10. Инд – кислотный хром черный специальный.
Хранение: в хорошо упакованной таре
Применение: вяжущее, подсушивающее, дезинфицирующее, при кожных заболеваниях.
Bismuthi subnitras – висмута нитрат основной.
Описание: белый аморфный или микрокристаллический прошок. Смоченный водой окрашивает синюю лакмусовую бумагу в красный цвет.
Растворимость: практически нерастворим в воде и спирте, легко растворим в азотной и соляной кислоте.
Подлинность:
С сульфидом натрия выпадет коричнево-черный осадок, растворимый в концентрированной азотной кислоте.
2Bi3+ + 3Na2S à Bi2S3¯ + 3K+
Bi2S3 + 6HNO3 à 2Bi(NO3)3 + 3H2S
С KI выпадет черный осадок, растворимый в избытке KI (образуется желто-оранжевый комплекс).
Bi3+ + 3KI à BiI3¯ + 3K+ 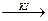 K[BiI4]
K[BiI4]
При прокаливании выделяются желто-бурые пары и остаток ярко-желтого цвета.
Висмута нитрат основной  2Bi2O3 + H2O + 2NO2 + O2
2Bi2O3 + H2O + 2NO2 + O2
Допустимые примеси: хлориды щелочных и щелочно-земельных металлов, серебро.
Недопустимые примеси: CO3, NH4, Cu, Pb, SO4, As, Te
Количественное определение: прямая комплексонометрия. Индикатор: пирокатехиновый фиолетовый. рН=2-3 (HNO3). Титрант – трилон Б.
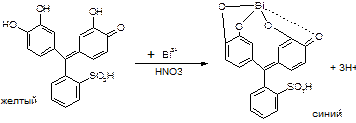
Вторая и третья стадии см. Магния сульфат.
Расчет ведут по Bi2O3. Расчетная формула для прямого титрования без контрольного опыта.
Хранение: в хорошо упак. таре, предохр. от д-я света.
Применение: Вяжущее антисептическое при заболеваниях ЖКТ.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 747; Нарушение авторских прав?; Мы поможем в написании вашей работы!