
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы к.о
|
|
|
|
ОВР
Химические свойства
Препараты альдегидов и их производных.
Карбонильная группа – плоская, сильно поляризованная (на кислороде "-"), высокая реакционоспособность. То наркотики, антисептики, токсические вещества. Дополнительное введение галогена увеличивает активность и токсичность. Введение гидроксильной группы уменьшает токсичность и увеличивает способность образования гидратных связей.
Cl3C-CO-H + H2O à Cl3C-CH(OH)2 хлоралгидрат (мало токсичен).
Легко окисляются до кислот. Эффект реакций не зависят от природы альдегида, а зависят от природы окислителя
а) с реактивом Толленса. – реакция серебряного зеркала. В кристально чистой пробирке образуется налет серебра.
R-CHO + 2[Ag(NH3)2]NO3 + H2O 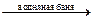 Ag¯ + RCOONH4 + NH3 + NH4NO3
Ag¯ + RCOONH4 + NH3 + NH4NO3
Реактив готовят:
К AgNO3 прибавляют концентрированный NH4OH до растворения осадка. При хранении может образовывать аред серебра (взрывчатый).
б) с реактивом Фелинга
Реактив – смесь равных объемов раствора Фелинга 1 (CuSO4 + следов. H2SO4 – прозрачная жидкость голубоватого цвета) и раствора Фелинга 2 (сеньетова соль – тартрат калия натрия в растворе щелочи).
Собственно реактив Фелинга – прозрачная жидкость ярко-синего цвета, комплекс соли меди (нижеприведенная формула – по Ильиной Татьяне Юрьевне; Трусов же Сергей Николаевич представляет себе комплекс меди с калия натрия татртратом несколько иначе – по его мнению, медь связывается по спиртовым гидроксилам только лишь с одной молекулой винной кислоты).
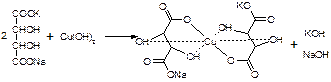
При добавлении альдегида и кипячении на водяной бане, выпадает осадок красно-бурого цвета.
Альдегид + комплекс Фелинга + KOH + 3NaOH 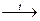 CuOH + кислая Калиевая соль винной кислоты + кислая Натриевая соль винной кислоты + 2H2O
CuOH + кислая Калиевая соль винной кислоты + кислая Натриевая соль винной кислоты + 2H2O
2CuOH à Cu2O + H2O
Гидроксид меди 1 – желтоватого цвета, очень неустойчив и быстро разлагается до кирпично-красного оксида.
Реактив Фелинга не реагирует с ароматическими альдегидами, кроме 2,4 дигидроксибензаля.
в) с реактивом Несслера.
RCHO + K2[HgI4] + 3KOH à Hg¯ + RCOOK + 4KI + 2H2O
Реакция идет мгновенно с формальдегидом. Кетоны не реагируют. Реакция очень чувствительна, используется для обнаружения примеси альдегида в спиртах, эфирах и для к.о. альдегидов.
г) реакция обесцвечивания раствора йода.
RCHO + I2 + H2O 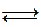 RCOOH + 2HI
RCOOH + 2HI
Реакцию ведут в слабощелочной среде, используют для к.о. альдегида.
д) тетразолиевая проба.
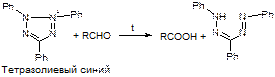
2. Реакции нуклеофильного присоединения.
а) с реактивом Шиффа

В эту реакцию вступают почти все алифатические альдегиды (кроме хлоралгидрата), некоторые кетоны, ароматические альдегиды. При рН<1 эта реакция специфична для формальдегида.
Используют для обнаружения примеси формальдегида и метанола после окисления его до формальдегида
б) с азотсодержащими реактивами:
R-CHO + NH3 à RCH=NH
R-CHO + NH2OH 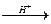 R-CH=N-OH (оксимы)
R-CH=N-OH (оксимы)
R-CHO + NH2-NH2 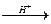 R-CH=N-NH2 (гидразоны), R-CH=N-N=CH-R (азины)
R-CH=N-NH2 (гидразоны), R-CH=N-N=CH-R (азины)
R-CHO + Ph-NH-NH2 (фенил гидразин) 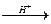 R-CH=N-NH-Ph (фенилгидразоны)
R-CH=N-NH-Ph (фенилгидразоны)
R-CHO + (о,п–NO2)2Ph-NH-NH2 (2,4 динитрофенилгидразин) 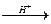 R-CH=N-NH-Ph(о,п-NO2)2.
R-CH=N-NH-Ph(о,п-NO2)2.
Применение: Для подлинности, т.к. выпадает кристаллические осадки с четкими температурами плавления. Для к.о. (гравиметрия или тритриметрия).
в) Присоединение бисульфита натрия (сульфита натрия).
RCHO + NaHSO3 «R-CH(OH)-SO3Na¯
При нагревании в кислой среде разрушаются с выделением NaCl, H2O, SO2
Использование: для очистки и разделения смеси альдегидов и метилкетонов.
Для количественного определения:
RCHO + Na2SO3 «R-CH(OH)-SO3Na¯ + NaOH (эквивалентное количество).
3. Реакции конденсации с фенольными соединениями. SE в ядро.
а) р. Хичкока.
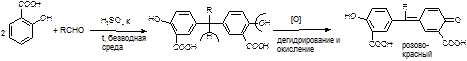
В результате реакции получается ауриновый краситель розово-красного цвета.
В случае формальдегида возможно образование триспроизводных трифенилметанового ядра.
Реактив Марки – это раствор формаля в концентрированной серной кислоте.
б) р. Идрайве.
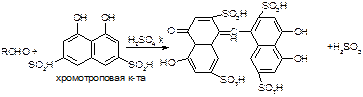
Хромотроповая кислота, она же 1,8-дигидроксинафталин, 3,6-дисульфокислота или ее динатриевая соль.
Получается фиолетовое вещество, в случае формаля – пурпурное.
4. Реакция линейной и циклической полимеризации.
Используются для получения гексаметилентетрамина и длительном хранении.
nHCHO + H2O à HCH(OH)2 «(HO-CH2-O-CH2-O-)n, -(CH2-O-)n – параформ, белая кристаллическая масса.
Физико-химический анализ по карбонильной группе затруднен, т.к. группа – слабый хромофор.
ФХМА используются редко.
1. Окислительно-восстановительные (титриметрические).
2. Реакции конденсации (фотометрические методы), гравиметрические методы.
Препараты:
Solutio Formaldehydi (Formalinum). Формальдегид – водный раствор 37%
Описание: бесцветная, прозрачная жидкость со своеобразным острым запахом, смешивается во всех соотношениях с водой и спиртом. В качестве стабилизатора содержит метанол до 1%, он также предотвращает реакцию полимеризации.
Получение:
2CH3OH + O2 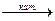 HCHO + 2H2O
HCHO + 2H2O
Подлинность:
1. Реакция серебрянного зеркала (см. химические свойства 1а).
2. C салициловой кислотой (см. химические свойства 3а).
Чистота: допустима примесь HCOOH не > 0,2%, ее определяют, титруя щелочью (алкалиметрически) с индикатором ФФ.
КО:
1) Обратная йодометрия в щелочной среде.
Аликвота + избыток титрованного раствора I2 + щелочь. I2 в щелочной среде диспропорционирует с образованием NaIO, который окисляет HCHO до HCOONa.
I2 + 2NaOH à NaIO + NaI + H2O
побочно: 3NaIO à NaIO3 + 2NaI
Ставим в темное место, подкисляя H2SO4
HCHO + NaIO + NaOH à HCOONa + NaI + H2O
NaI + NaIO + H2SO4 à I2 + Na2SO4 + H2O
Титруем 0,1М Na2S2O3
I2 + Na2S2O3 à 2NaI + Na2S4O6
f(HCHO) = ½
Параллельно ставим контрольный опыт.
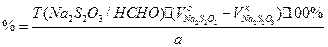
Нефармакопейные:
1) С реактивом Несслера – обратная йодометрия по отношению к ртути, избыток йода оттитровываем Na2S2O3. С реактивом Несслера (K2HgI4) образуется свободная ртуть.
Hg + I2 à HgI2¯ 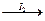 H2HgI4
H2HgI4
f= ½
2) Бисульфитный метод.
HCHO + Na2SO3 à HO-CH2-SO3Na•NaOH
NaOH + HCl à NaCl + H2O
Титруют раствором хлороводорода 0,1М. Индикатор – ФФ, до исчезновения розовой окраски.
f=1
Параллельно контрольный опыт
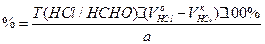
3) Окисление перекиси – алкалиметрия в присутствии пергидроля.
HCHO + H2O2 + NaOH(изб) 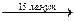 HCOONa + 2H2O
HCOONa + 2H2O
Избыток NaOH оттитровываем HCl.
Индикатор – ФФ или БТС
f=1
Контрольный опыт
4) Гидроксиламиновый
HCHO + NH2OH•HCl à H2C=N-OH + HCl
HCl титруют NaOH. Индикатор БТС.
f=1
Расчетная формула без контрольного опыта.
4) Рефрактометрия
5) Спектрофотометрия
Применение: Антисептик, дезинфектант
Хранение: в склянке оранжевого стекала при температуре не менее 9 С.
Рецептура: Если раствор формальдегида, то исходят из фактической концентрации (37%). Если раствор формалина, то 37% раствор принимают за 100% и уже исходя из этого готовят разведение
При вдыхании - отравление, слезоточивость, кашель. При употреблении внутрь – тошнота, понос.
Chlorali hydras – 2,2,2трихлорэтандиол 1,1. Cl3C-CH(OH)2
Описание: бесцветные прозрачные кристаллы с характерным запахом, на воздухе улетучивается, гигроскопичен, легко растворим в воде, спирте, эфире и CHCl3
Подлинность:
1. Гидролиз щелочной при комнатной температуре. Растворяем в воде, добавляем щелочь, взбалтываем. Образуется мутная жидкость с характерным запахом хлороформа.
Cl3C-CH(OH)2 + NaOH à CHCl3 + HCOONa + H2O
2. С реактивом Толленса. Образуется черный осадок серебра. Мгновенная реакция.
Cl3C-CH(OH)2 + [Ag(NH3)2]NO3 à Ag¯ + Cl3-C-COOH + NH3 + NH4NO3
Нефармакопейные:
1. Реакция конденсации с фенольными соединениями в щелочной среде.
Cl3C-CH(OH)2 + NaOH à CHCl3 + HCOONa + H2O
CHCl3 + NaOH à CCl2 (дихлоркарбен) + NaCl + H2O
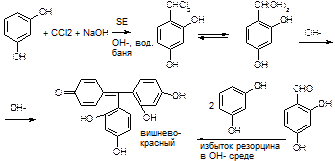
При нагревании с резорцином в щелочной среде. Аналогично - с фенолом и тимолом.
Чистота: прозрачность и цветность, кислотность (МО должен быть желтым), органические примеси (обнаруживают по реакции с концентрированной H2SO4).
Общедопустимые примеси: хлориды и тяжелые металлы.
Специфические недопустимые: хлоральалкоголят (он же моноэтилацеталь хлоральгидрата). Не должно быть осадка и запаха йодоформа при нагревании с йодом в щелочной среде. Йодоформная проба (выпадает желтый кристаллический осадок с характерным запахом):
Cl3C-CH(OH)-OC2H5 + NaOH 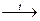 C2H5OH + Cl3C-CH(OH)2
C2H5OH + Cl3C-CH(OH)2
C2H5OH + 4I2 + 6NaOH 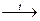 CHI3¯ + HCOONa
CHI3¯ + HCOONa
КО:
Обратная Алкалиметрия.
Cl3C-CH(OH)2 + NaOH изб à CHCl3 + HCOONa
После добавления NaOH, ее избыток оттитровывают соляной кислотой. Индикатор ФФ – до исчезновения розовой окраски. f=1 Контрольный опыт.
Нефармакопейные:
Обратная йодометрия в щелочной среде или среде карбонатного буфера.
Аликвота + избыток йода, оттитровывают Na2S2O3
f=1/2 (если окисляется до кислоты)
Применение: мягкое успокаивающее, седативное и снотворное, в детской практике. В порошках и клизмах. Противосудорожное.
Хранение: по списку Б, в хорошо упакованной таре в темном месте, на свету разлагается с образованием:
2CCl3CHO 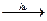 Cl2CH-CHO + Cl3-C-COOH + HCl + H2O
Cl2CH-CHO + Cl3-C-COOH + HCl + H2O
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 929; Нарушение авторских прав?; Мы поможем в написании вашей работы!