
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие
|
|
|
|
Определение.
Состояние ТДС
Состояние ТДС – это совокупность всех ее измеримых макроскопических свойств, имеющих, следовательно, количественное выражение. Макроскопический характер свойств означает, что их можно приписать только к системе в целом, а не отдельным частицам, которые составляют ТДС (Т, р, V, c, U, nk). Количественные характеристики состояния связаны между собой. Поэтому существует минимальный набор характеристик системы, называемых параметрами, задание которых позволяет полностью описать свойства системы. Количество этих параметров зависит от типа системы. В простейшем случае для закрытой гомогенной газовой системы в состоянии равновесия достаточно задать только 2 параметра. Для открытой системы кроме этих 2 характеристик системы требуется задать число молей каждого компонента.
Классическая термодинамика обычно ограничивается рассмотрением равновесных состояний ТДС. Равновесие - это такое состояние, к которому самопроизвольно приходит ТДС, и в котором она может существовать бесконечно долго в отсутствие внешних воздействий. Для определения равновесного состояния всегда требуется меньшее количество параметров, чем для неравновесных систем.
2.2.3. Уравнение соcтояния связывает параметры состояния и относится к фазе. Общий вид его f (p,V, T) = 0. Простейший вид уравнения состояния имеет идеальный газ pV = nRT, ( 1.1 )
где R = 8.314 Дж/(моль.К) = 1,987 кал/(моль.К) = 0,082 л.атм/(моль.К).
[p] = Па, 1атм = 1,013*105 Па = 760 мм рт.ст.,
[V ] = м3, 1 м3 = 103 л,
[T] = К,
[n] = моль, N = 6.02*1023 моль-1= 6,02*1026 кмоль-1 .
2.2.4. Функции сост ояния – это характеристики системы, которые зависят только от параметров состояния, но не зависят от способа его достижения.
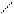
 ∙ F (x,y), например, F (V,T)
∙ F (x,y), например, F (V,T)
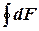 = 0, dF – полный дифференциал
= 0, dF – полный дифференциал
 dF =
dF = 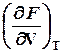 dV +
dV + 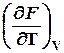 dT, (1.2)
dT, (1.2)
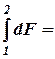 F 2 – F 1 = D F. (1.3)
F 2 – F 1 = D F. (1.3)
Изменение функции состояния не зависит от пути перехода, а определяется только начальным и конечным состоянием, DF – всегда разность между конечным (F 2) и начальным (F 1) состоянием.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 646; Нарушение авторских прав?; Мы поможем в написании вашей работы!