
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для каждой фазы a, содержащей k компонентов, существует аддитивная функция состояния, называемая энтропией
|
|
|
|
Классификация процессов с точки зрения 2 закона термодинамики.
Второй закон термодинамики
Первый закон термодинамики устанавливает эквивалентность различных видов энергии и форм их передачи. 2-ой закон термодинамики говорит скорее об обратном. Теплота и работа в определенном смысле неэквивалентны – всю работу можно превратить в тепло, а все тепло перевести в работу в периодическом, т.е. циклически повторяющемся процессе нельзя. Все самопроизвольные процессы протекают в одном направлении. Назначение 2-го закона термодинамики – установление критериев самопроизвольного протекания разнообразных процессов.
5.1.1. Самопроизвольные процессы выравнивания, протекающие в системе без внешних воздействий, они идут до установления равновесия. Самопроизвольные процессы всегда протекают в одном направлении.
За счет самопроизвольных процессов может быть получена работа: например, за счет разности давлений можно получить механическую работу или работу электрическую - пьезоэлектричество; за счет разности температур может работать тепловой двигатель или термопара, в процессе установления химического равновесия можно получить электрическую работу – в гальваническом элементе.
5.1.2. Несамопроизвольные не могут протекать в системе в отсутствие внешних сил
5.1.3. Обратимые, равновесные, квазистатические, или регулируемые процессы, после циклического их завершения не остается никаких изменений ни в системе, ни в окружающей среде. Это идеализированные процессы, которые характеризуются следующими особенностями:
1) внешние и внутренние силы почти скомпенсированы и различаются на бесконечно малую величину, например ре » -рi;
2) могут изменять направление при бесконечно малом изменении внешних сил;
3) в прямом и обратном направлении процесс протекает через одни и те же промежуточные состояния – по одному и тому же пути;
4) бесконечно медленно;
5) могут быть изотермическими или адиабатическими;
6) |dW| полученная = |dW|затраченная;
7) dWобр = dWmax. > dWнеобр ..
8) Необратимых путей множество, а обратимый только один. Для проведения обратимого процесса нужно искусственно тормозить его, прилагая внешнюю силу, преодоление которой позволяет извлекать из системы максимальную работу. Для получения такого результата необходимо иметь некоторое усторойство (тепловой двигатель, галь-ванический элемент и т.п.). Обратимый – идеализированный полностью регулируемый процесс.
5.2. Формулировки второго закона термодинамики. Закон прошел длительный путь эволюции и сначала был сформулирован как основной закон действия тепловых машин
5.2.1. Теорема Карно (1824) “Размышление о движущей силе огня” – коэффициент полезного действия обратимого цикла, состоящего из 2 изотерм и 2 адиабат, зависит только от разности температур тепловых резервуаров и не зависит от природы рабочего тела
h = (Q1 – Q2)/Q1 = (T1 –T2)/T1 = 1 – Т2/Т1. ( 5.1 )
5.2.2. Томсон (лорд Кельвин) (1848) ввел понятие абсолютной температуры и (1851) сформулировал 2 закон ТД – невозможно построить периодически действующую тепловую машину, которая только бы черпала тепло из одного резервуара и производила механическую работу, т.е. невозможен вечный двигатель 2-го рода
5.2.3. Клаузиус (1850) дал первую формулировку 2 закона ТД – невозможен самопроизвольный переход теплоты от тела менее нагретого к телу более нагретому. Обе формулировки эквивалентны, одна невозможна без другой. (1854) Ввел понятие энтропии.
5.2.4. Математическое выражение 2 –го закона ТД
Sa = Sa(Ua, Va, n1a, na2,..nak); 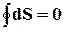 , S =
, S = 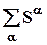 , DS = S2 – S1
, DS = S2 – S1
 изменение которой следующим образом связано с теплотой и температурой процесса р
изменение которой следующим образом связано с теплотой и температурой процесса р
 dS =
dS = 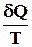
 для обратимых процессов; (5.1) p1 V1 T1 S1
для обратимых процессов; (5.1) p1 V1 T1 S1
 dS >
dS > 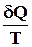 для необратимых процессов. (5.2) p2V2 T2 S2
для необратимых процессов. (5.2) p2V2 T2 S2
(Неравенство Клаузиуса) V
Рис. 5.1. К понятию энтропии.
Температура – интегрирующий делитель, который превратил функцию процесса в изменение функции состояния, а энтропия – тепловая координата.
Работу всегда можно выразить как произведение интенсивного параметра на изменение экстенсивного
dW= - 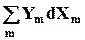 , ( 5.3 ),
, ( 5.3 ),
а теплоту – аналогично dQ = TdS – для обратимых процессов, (5.4)
где Т – интенсивный параметр, а dS изменение экстенсивного свойства.
Объединяя 1 и 2 законы термодинамики (уравнения 2.2 и 5.1), получаем
d U = TdS – pdV + 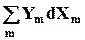 . (5.5)
. (5.5)
5.2.5. Анализ уравнений типа (5.5) привел Каратеодори к новой формулировке 2-го закона термодинамики, не связанной с тепловыми машинами:
вблизи любого состояния термически однородной и адиабатически изолированной системы есть бесконечное множество других состояний, не достижимых адиабатическим путем. В этом случае Т становится интегрирующим делителем, а S – функцией состояния.
5.3 Расчет изменения энтропии в различных процессах.
Изменение энтропии нельзя непосредственно измерить, измерять можно только теплоту. Количество теплоты может быть различным в обратимом и необратимом процессе, но изменение энтропии в них должно быть одинаковым, если одинаковы начальное и конечное состояния
dSобр. = 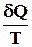 обр.
обр.


S2 – S1 = dSнеобр. > 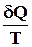 необр Þ
необр Þ 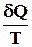 обр.
обр. >
> 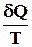 необр. (5.6)
необр. (5.6)
Как и работа, теплота обратимого процесса всегда больше теплоты необ-ратимого при заданных начальном и конечном состояниях.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 346; Нарушение авторских прав?; Мы поможем в написании вашей работы!