
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические реакции
|
|
|
|
Фазовые переходы
P,T p,T p,T


nk/ Snk = Nk мольная доля
DS = DSa + DS b = na R ln 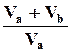 + nb R ln
+ nb R ln 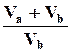 =
=
= na R ln 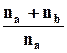 + nb R ln
+ nb R ln 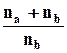 = -R(na ln Na + nblnNb). (5.10)
= -R(na ln Na + nblnNb). (5.10)
Изменение энтропии при смешении газов зависит от концентрации получаемой смеси, Это изменение всегда положительно, так как мольная доля всегда меньше единицы, а ее логарифм – отрицателен.
dS = 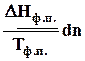 Þ DS =
Þ DS = 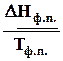 , (5.11)
, (5.11)
так как фазовые переходы чистых веществ произходят при постоянной температуре, если зафиксировано давление.
DrS = Snj Sj - S½ni½ Si = Snk Sk. (5.12)
5.4. Энтропия – критерий направления самопроизвольных процессов в изолированной системе. dQ = 0, dV = 0, d U = 0 Þ
dSU,V > 0 самопроизвольный процесс; (5.13)
dSU,V = 0 равновесие; (5.14)
в стабильном равновесии изолированная система достигает максимума энтропии (dS2/dХ2) U,V < 0. (5.15)
В неизолированной системе энтропия может уменьшаться, но при этом должен происходить рост энтропии в окружающей среде.
Таблица 5.1. Изменение энтропии в различных процессах в системе и окружающей среде
| Процесс | DSсистемы | DSокр. среды | DSобщ. |
| Циклический обратимый | |||
| Нециклический обратимый | >0 | <0 | |
| - “ - | < 0 | > 0 | |
| Циклический необратимый | >0 | >0 | |
| Нециклич. необратимый | >0 | <0 | >0 |
| - “- | <0 | >0 | >0 |
Лекция № 6
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 255; Нарушение авторских прав?; Мы поможем в написании вашей работы!