
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамическая вероятность
|
|
|
|
5.5.3.1. В равновесии термодинамические параметры системы постоянны, но микрохарактеристики молекул претерпевают непрерывные изменения. Таким образом, макросостояния системы реализуется множеством микросостояний. Число микросостояний, совместимых с данным макросостоянием, называется термодинамической вероятностью
5.5.3.2. Принципы расчета термодинамической вероятности.
5.5.3.2.1. Микросостояния отличаются друг от друга перестановкой частиц.
5.5.3.2.2. Перестановки внутри одной ячейки не ведут к новому микросостоянию, так как состояния внутри ячейки неразличимы.
5.5.3.2.3. В одно макросостояние входят все микросостояния с одинаковым количественным распределением частиц по ячейкам, т.е. задать макросостояние на микроуровне можно определением числа частиц в каждой ячейке фазового пространства Ni.
5.5.3.2.4. Основной постулат – для изолированной системы (U= const): все S N
микросостояний имеют одинаковую вероятность, т.е. функция распределения r = const. Это позволяет легко рассчитывать термодинамическую вероятность состояния системы, состоящей из N частиц, распределенных по s ячейкам фазового пространства, используя формулу комбинаторики для числа перестановок:
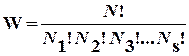 , (6.2)
, (6.2)
Пример: 2 частицы в двух ячейках (микросостояниях), N = 2, S = 2.
| 1, 2 | |||
| 1, 2 |
4 микросостояния (22) разбиты на 3 макросостояния:
| N1 | N2 | W |
5.5.3.3. Наибольшая термодинамическая вероятность получается при равномерном распределении N частиц по ячейкам с одинаковой энергией.
 . (6.3)
. (6.3)
С увеличением числа частиц термодинамическая вероятность равномерного распределения частиц по ячейкам очень сильно возрастает
N S Wmax
2 2 2
4 2 6
6 3 15
15 3 756756
5.5.3.4. Направление самопроизвольных процессов. Изолированная термодинамическая система стремится к состоянию с наибольшей термодинамической вероятностью, которое достигается при установлении равновесия.
5.5.4. Связь энтропии с термодинамической вероятностью предложена на основании свойств энтропии и термодинамической вероятности
Аддитивность энтропии S = f(W); S = S1 + S2.
Мультипликативность термодинамической вероятности W = W1*W2.
S(W) = S(W1*W2) = S1(W1) + S2 (W2) Þ S = k ln W, (6.4)
где k – постоянная Больцмана.
Таким образом, энтропия характеризует неупорядоченность системы, ее беспорядок.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 517; Нарушение авторских прав?; Мы поможем в написании вашей работы!