
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первое начало термодинамики
|
|
|
|
Эквивалентность теплоты и работы.
Обмен энергией между термодинамической системой и внешними телами можно осуществить двумя различными способами:
· путем совершения работы и
· путем теплообмена.
Работа совершается при силовом взаимодействии между телами.
Работу над системой производят внешние силы. Для совершения работы над макроскопической неподвижной системой нужно, чтобы перемещались взаимодействующие с ней тела, т.е. чтобы изменились внешние параметры состояния системы. В отсутствие внешних полей (силовых) обмен энергией между неподвижной системой и внешней средой может совершаться за счёт совершения работы лишь в процессе изменения объёма и формы системы. Работа А', совершаемая внешними телами над системой, численно равна и противоположна по знаку работе А, совершаемой самой системой над внешней средой, т.е. против внешних сил: A' = - A.
Теплообмен происходит между телами или частями одного тела, нагретыми до различной температуры.
В отличие от внутренней энергии системы, которая является однозначной функцией состояния системы, понятие теплоты и работы имеют смысл только в связи с процессом изменения состояния системы. Они являются энергетическими характеристиками этого процесса.
В соответствии с законом сохранения энергии при любом способе перехода системы из одного состояния в другое изменение внутренней энергии ∆U = U2 – U1 будет одинаковым и равным разности между количеством теплоты Q, полученной системой, и работой А, совершенной системой против внешних сил.
∆U = Q – A
или Q = ∆U + A – первое начало Т.Д.
Теплота, сообщаемая системе, расходуется на изменение её внутренней энергии и на совершение ею работы против внешних сил. В дифференциальной форме
dQ = dU + dA
или более корректно 
В этом выражении dU – полный дифференциал, а  и
и 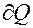 таковыми не является.
таковыми не является.
§2.20. Теплоёмкость многоатомных газов.
Удельная теплоёмкость
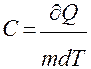 (единица массы вещества)
(единица массы вещества)
Молярная теплоёмкость –
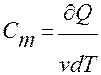
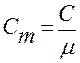 (1моль вещества)
(1моль вещества)
Различают теплоёмкости при постоянном объёме и постоянном давлении, если в процессе нагревания вещества его объём или давление остаётся постоянным. Для одного моля газа

Из первого начала Т.Д. имеем:
Cm · dT =dUm + РdVm
при V = const → Cm dT = CV · dT = dUm
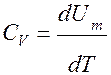 .
.
Для произвольной массы газа
 ,
,
следовательно


при P = const
 откуда
откуда
 но
но 
 .
.
Из уравнения Менделеева-Клапейрона
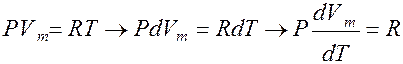
откуда
CP = CV + R – уравнение Майера.
но т.к. 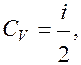 то
то

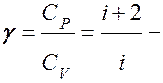 коэффициент Пуассона.
коэффициент Пуассона.
СP и СV не зависят от температуры, а определяются лишь числом степеней свободы. Это утверждение МКТ справедливо в довольно широком интервале температур лишь для одноатомных газов.
Уже для двухатомных газов число степеней свободы зависит от температуры.
Для двухатомной молекулы есть три поступательных, две вращательных и одна колебательная степень свободы (на колебательную степень свободы приходится 2 степени свободы – потенциальная и кинетическая энергии).
По закону равномерного распределения энергии по степеням свободы для комнатных температур  Эксперимент даёт для молекулы водорода Н2 следующую зависимость
Эксперимент даёт для молекулы водорода Н2 следующую зависимость
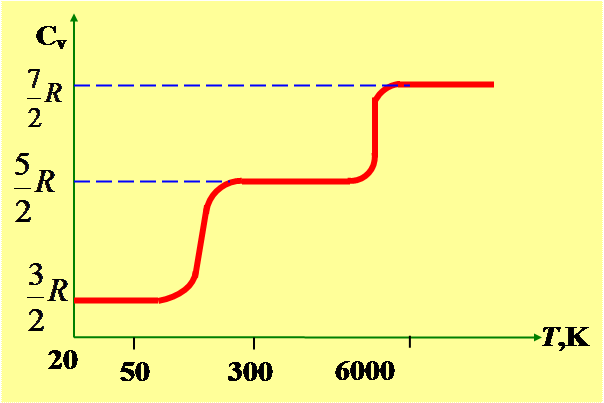
При низких температурах наблюдается только поступательное движение (колебательные 
 и вращательные степени свободы,,выморожены”) при более высоких температурах добавляется вращение, а при высоких ещё и колебания молекул.
и вращательные степени свободы,,выморожены”) при более высоких температурах добавляется вращение, а при высоких ещё и колебания молекул.
Расхождение теории и эксперимента объясняется квантованием колебательной и вращательной энергии. Если энергия теплового движения недостаточна для возбуждения колебаний, то эти колебания не вносят вклада в теплоёмкость, соответствующая степень свободы,,замораживается” и к ней неприменим закон о распределении энергии. Аналогично можно объяснить уменьшение теплоёмкости при низкой температуре -,,замораживается” вращательные степени свободы.
В этом – недостатки классической теории теплоёмкости.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 294; Нарушение авторских прав?; Мы поможем в написании вашей работы!