
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисление и применение энтропии
|
|
|
|
Пример.
Свойства энтропии.
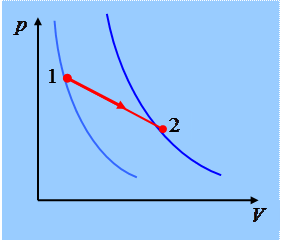
1. Энтропия – функция состояния. Если процесс проводят вдоль адиабаты, то энтропия системы не меняется. Значит адиабаты – это одновременно и изоэнтропы. Каждой более,,высоко” расположенной адиабате отвечает большое значение энтропии.
2. Энтропия – величина аддиативная: энтропия макросистемы равна сумме энтропий ее отдельных частей.
3. Одно из важнейших свойств энтропии заключается в том, что энтропия замкнутой (т.е. теплоизолированной) макросистемы не уменьшается – она либо возрастает, либо остается постоянной.
Принцип возрастания энтропии замкнутых систем представляет собой еще одну формулировку второго начала термодинамики.
Величина возрастания энтропии в замкнутой макросистеме может служить мерой обратимости процессов, протекающих в системе.
Идеальный газ, находящийся в некотором состоянии, адиабатически (т.е. без теплообмена) расширили до объема 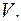 Одинаково ли будет установившееся давление газа в конечном состоянии (в объеме
Одинаково ли будет установившееся давление газа в конечном состоянии (в объеме 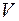 ), если процесс расширения
), если процесс расширения
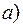 обратимый,
обратимый,
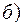 необратимый
необратимый
В соответствии с принципом возрастания энтропии в замкнутой системе при необратимом процессе энтропия должна увеличиваться. Значит установившееся состояние будет соответствовать точке на более высокой адиабате, т.е. давление будет больше.
Теорема Нернста (1906). Это теорема утверждает, что при приближении температуры к абсолютному нулю энтропия макросистемы также стремится к нулю:
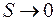 при
при 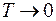
и мы можем вычислять абсолютное значение энтропия по формуле
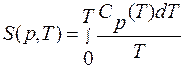
1. Основное уравнение термодинамики. Оно представляет собой объединение энтропии с первым началом. 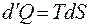 . Для обратимых процессов:
. Для обратимых процессов:
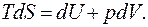
Это уравнение имеет многочисленные применения.
2. Энтропия идеального газа. Пусть начальное и конечное состояния, 1 и 2, газа определяются параметрами 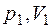 и
и 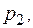
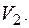
Элементарное приращение энтропии газа с учетом, что 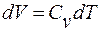 и
и 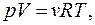 определяется как
определяется как
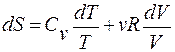
Взяв дифференциал логарифма от 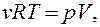 получим
получим
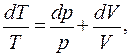
формуле можно придать симметричный вид:
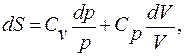
где учтено, что 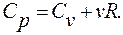
Проинтегрировав последнее выражение получим в результате
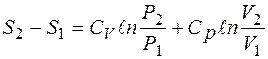
3. Приращение энтропии при необратимом процессе между двумя равновесными состояниями 1 и 2. Приращение энтропии по обратимому изотермическому процессу:
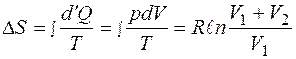 > 0.
> 0.
4. Возрастание энтропии при смешении газов. Пусть в двух половинах теплоизолированного сосуда объемом  находятся два идеального газа, 1 и 2, разделенных перегородкой. Температура, давление и число молей
находятся два идеального газа, 1 и 2, разделенных перегородкой. Температура, давление и число молей  и обеих половинах одинаково. После удаления перегородки начинается необратимый процесс смешения газов. В конце концов он прекращается, и система приходит в равновесное состояние, в котором оба газа равномерно перемешаны. Температура в конечном состоянии будет такая же, так как система теплоизолирована и газы идеальные. Используя результат предыдущего примера, находим, что при
и обеих половинах одинаково. После удаления перегородки начинается необратимый процесс смешения газов. В конце концов он прекращается, и система приходит в равновесное состояние, в котором оба газа равномерно перемешаны. Температура в конечном состоянии будет такая же, так как система теплоизолирована и газы идеальные. Используя результат предыдущего примера, находим, что при 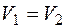 приращение энтропии каждого газа
приращение энтропии каждого газа 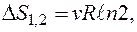 т.е. суммарное приращение энтропии системы
т.е. суммарное приращение энтропии системы
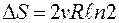
Приращение ∆S > 0, что естественно, поскольку процесс смещения существенно необратимый (обратимый процесс – самораспределение смеси двух газов – совершенно невероятен). Последняя формула приводит к выводу, называемому парадоксом Гиббса. Формула 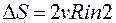 справедлива только при смешивании различных газов.
справедлива только при смешивании различных газов.
§2.28. Цикл Карно .
Карно рассмотрел цикл на двух изотерм и двух адиабат.
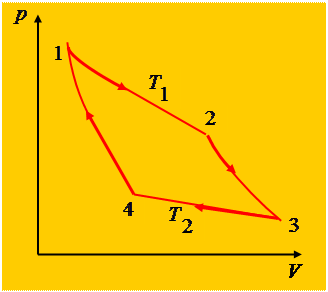
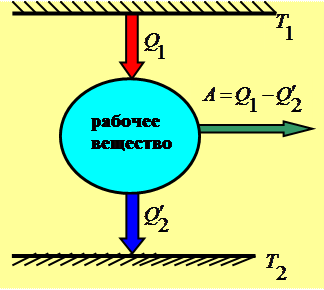
При изотермическом расширении 1-2 газ находится в контакте с нагревателем 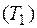 . Пусть при этом газ получает тепло
. Пусть при этом газ получает тепло 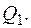 На изотерме 3 - 4 газ отдает тепло
На изотерме 3 - 4 газ отдает тепло 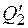 холодильнику
холодильнику 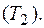 В соответствии с (3.1) КПД двигателя
В соответствии с (3.1) КПД двигателя
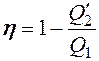
Данный цикл является обратимым (если его проводить бесконечно медленно). Он может быть проведен в обратном направлении, и при этом газ совершает отрицательную работу, нагреватель получает обратно тепло 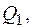 холодильник отдает газу тепло
холодильник отдает газу тепло 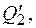 которое он получил в прямом цикле. Именно так в принципе работает любой бытовой холодильник.
которое он получил в прямом цикле. Именно так в принципе работает любой бытовой холодильник.
Дальнейшее рассуждения проще всего провести, изобразив цикл. Карно не на диаграмме  а на диаграмме
а на диаграмме  (энтропия - температура).
(энтропия - температура).
На этой диаграмме цикл Карно имеет вид прямоугольника.
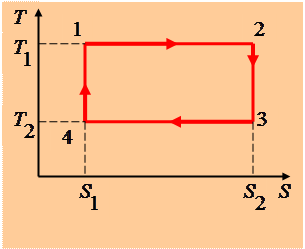
Изотермы изображаются прямыми 1-2 и 3- 4, адиабаты – прямыми 2-3 и 4-1. Полученное тепло 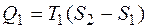 и равно площади под отрезком 1-2. Отданное холодильнику тепло
и равно площади под отрезком 1-2. Отданное холодильнику тепло 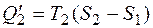 и равно площади под отрезком 4-3. При этом площадь прямоугольника, т.е.
и равно площади под отрезком 4-3. При этом площадь прямоугольника, т.е. 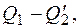 равна работе А, совершаемой двигателем за цикл. КПД обратимых двигателей, работающих по циклу Карно, зависит от температур
равна работе А, совершаемой двигателем за цикл. КПД обратимых двигателей, работающих по циклу Карно, зависит от температур 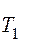 и
и 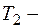 нагревателя и холодильника, но не зависит ни от устройства двигателя, ни от рода рабочего вещества.
нагревателя и холодильника, но не зависит ни от устройства двигателя, ни от рода рабочего вещества.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2651; Нарушение авторских прав?; Мы поможем в написании вашей работы!