
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория сильных электролитов Дебая-Хюккеля
|
|
|
|
Задача данной теории сводиться к моделированию межчастичных взаимодействий раствора. Основным практическим результатом должно было стать уравнение для расчета коэффициентов активности в растворах сильных электролитов. Данная теория использовала только закон кулоновских взаимодействий, что неправильно. Однако уравнение, полученное в выводе, удовлетворительно описывает некоторые закономерности.
Основные положения теории:
- Между молекулами существует только кулоновское взаимодействие.
- Благодаря этим взаимодействиям ионы располагаются упорядочено, однако вследствие теплового движения на дальних расстояниях данный порядок может нарушаться.
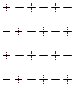



Рассматриваемый ион называется центральным, а ионы его окружающие – его атмосферой.
- Ионы считаются бесконечно малыми и могут считаться точечными зарядами.
- Пространство между ионами считается непрерывным и может характеризоваться непрерывной характеристикой – диэлектрической проницаемостью среды (
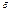 ).
). - Центральный ион формирует электрическое поле, которое характеризуется потенциалом, пропорциональным работе, которую необходимо совершить для того, чтобы удалить один заряд из данной точки пространства на бесконечно большое расстояние.
- Противоионы в ионной атмосфере располагаются в соответствии с распределением Больцмана по энергии:
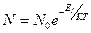
Была получена функция распределения ионов относительно центральных, а затем выражение для расчета коэффициента активности.
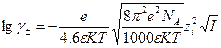
Z – заряд ионов
I – ионная сила раствора
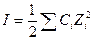
Для волных растворов при стандартных условиях:
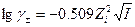 - предельный закон разбавления Дебая.
- предельный закон разбавления Дебая.
Оно хорошо работает для растворов с концентрацией, большей 0,001 моль/л
Основной недостаток: невозможность разделить неидеальность растворов на неидеальность катиона и неидеальность аниона.
Константы активности, рассчитанные по этим формулам, называются среднеионными, так как относятся ко всему раствору в целом.
Лекция №9
План лекции:
- Основные понятия фазового равновесия.
- Условие фазового равновесия.
- Однокомпонентные системы. Уравнение Клапейрона-Клаузиуса.
- Диаграмма состояния однокомпонентных систем.
- Бинарные гомогенные системы
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 617; Нарушение авторских прав?; Мы поможем в написании вашей работы!