
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантово-механическая модель атома, квантовые числа, типы атомных орбиталей
|
|
|
|
Классификация.
Способы выражения состава раствора. Концентрация (молярная, моляльная, массовая доли).
Растворы бывают: газовые (газовые смеси), жидкие и твердые. Относит. содержание компонента в растворе характеризуется его концентрацией.
По числу компонентов: Бинарные (2 компонента) и многокомпонентные. Растворитель — тот, что в избытке.
По агрегатному состоянию: Жидкие (водные и неводные) Твёрдые (растворы внедрения и замерзания) Газообразные (равновесные смеси газов в любых соотношениях)
По концентрации: Разбавленные (С £ 0,01) Концентрированные (С = 1 моль/л) Насыщенные (С > 1?)
По природе растворённого вещества: Электролиты (сильные (a = 1) и слабые (a < 30%)), a = распавшихся / растворённых. Неэлектролиты.
По реальности: Идеальные (нет взаимодействия между AX–S, S–S, AX–AX). AX — растворённое. Реальные.
Условие образования идеального раствора: DHид = 0, DS > 0, DV = 0.
Концентрация - отношение числа частиц компонента системы (смеси, р-ра, сплава), его кол-ва (молярная К.) или массы (массовая К.) / к объему системы. Единицы измерения - соотв. м-3, моль/м3 или кг/м3.
Молярная доля [%]: количество компонента в растворе / к общему количеству компонентов.
Молярная концентрация [моль/л]: (молярность) показывает число молей растворенного вещества, содержащегося в 1 литре раствора: М = v(Х) / V, где М - молярная концентрация растворенного вещества X, моль/л; v(Х) - количество растворенного вещества X, моль; V - объем раствора, л.
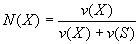
Моляльная доля растворенного вещества (Моляльность) [моль/кг] - безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
где N(Х) - мольная доля растворенного вещества X; v(Х) - количество растворенного вещества X, моль;
v(S) - количество вещества растворителя S, моль.
Массовая доля [%] - это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора ω(x) = m(x) / (m(x) + m(s)) = m(x) / m, где ω(х) - массовая доля растворенного вещества Х, m(x) - масса растворенного вещества Х, г; m(s) - масса растворителя S, г; m = m(x) + m(s) - масса раствора, г.
(Массовая доля: масса компонента / к массе раствора (сколько граммов на 100 г раствора).)
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 372; Нарушение авторских прав?; Мы поможем в написании вашей работы!