
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Валентность, степень окисления атома элемента в химическом соединении
|
|
|
|
Дипольный момент.
- мера полярности зим связи.
- произведение эффективного электрического заряда на длину химической связи.
· µ = |q|* l св, где q – заряд, l св – длина хим связи.
· µ = 0 – 10 Д. 1
· Д = 3,3*10-30 Кулон*метр.
CO2: О=С=О µсо=2,7 Д µсо2 = 0 - молекула неполярна, слабые межмолекулярные взаимод, газообразный состав в-ва.
H2O:  µH-O= 1, 58 Д µH2O = 1,7 Д молекула полярна, сильные межмолек взаимод, жидкое состояние.
µH-O= 1, 58 Д µH2O = 1,7 Д молекула полярна, сильные межмолек взаимод, жидкое состояние.
Валентность – способность образовывать химические связи (совпадает с числом неспаренных электронов в основном или возбужденном состояниях атома). Максимальная валентность совадает с номером группы, но есть случаи несоответствия.
Основное состояние – состояние с минимальной энергией, т.е электроны находятся ближе к ядру.
Возбужденное состояние (активное)– состояние, при котором все или часть электронов в атоме распарены и находятся на подуровне с большей энергией, т.е дальше от ядра.
Максимальная валентность наблюдается в возбужденном состоянии и как правило совпадает с номером группы, в которой находится элемент.
16S []… 3s  3p
3p 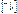

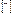 3d
3d 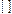
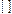
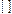
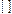
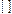 В=2 – Основное состояние
В=2 – Основное состояние
16S []… 3s  3p
3p 

 3d
3d 



 В*мах=6 – Возбужденное состояние
В*мах=6 – Возбужденное состояние
При возбуждении атома - распаривании электронных пар – неспаренные электроны могут переходить на вакантные орбитали, но конфигурация d-подуровня не меняется.
27Co []… 3d 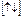
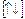
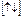

 4s
4s 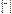 4p
4p 

 В=0 – Основное состояние
В=0 – Основное состояние
27Co []…3d 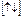



 4s
4s  4p
4p 

 В*мах=5 – Возбужденное состояние
В*мах=5 – Возбужденное состояние
Случаи несовпадения мах валентности
Элементы 2 периода N,O,F: из-за отсутствия вакантных орбиталей
| № гр | Вмах | |
| N | 3+1 | |
| O | ||
| F |
d-элементы 7-8 группы из-за нестабильности d подуровня
| № гр | Вмах | |
| Mn | ||
| Fe | ||
| Co | ||
| Ni | ||
| Cu |
Степень окисления — условный заряд атома в молекуле, вычисленный исходя из предположения, что вещество состоит только из ионов.
|
|
|
Степень окисления — это условный заряд атомов в молекуле, рассчитанный из предположения, что все электроные пары смещены к наиболее электроотрицательному элементу (или условный заряд, численно равный количеству смещенных электронных пар химической связи от атома или к атому)
P.S.:Степень окисления — это условный заряд, а валентность – число связей, не имеет знака.
8. Ковалентная связь. Насыщаемость, направленность. Строение, структурные формулы. Св-ва веществ.
Ковалентная связь – связь атомов за счет образования общей электронной пары с антипараллельными спинами.(между атомами неметаллов.)
Ковалентная неполярная D χ= χ(B)- χ(A)= от 0 до 0.4
Ковалентная полярная D χ= χ(B)- χ(A)= от 0,4 до 2
Насыщаемость
Так как число АО каждого атома ограничено, то и ограничено число химических связей, образующихся при перекрывании.
Свойство насыщаемости – определять количественный (стехиометрический) состав молекул
Направленность (только ковалентная) – определенное направление химической связи, которое возникает в результате перекрывания электронных облаков. Направленность определяется строением молекулы.
Так как атомные орбитали имебт определенное направление в пространстве, то хим связи направлены.
Ковалентная связь всегда действует в направлении мах перекрывание атомных орбиталей. Приводит к образованию прочной связи => прочная малекула.
Мах перекрыванию способствует явление гибридизации атомных орбиталей.
Гибридизация способствует наиболее полному перекрыванию АО. Это явление усреднения или смешивания разных по форме и энергии АО и образования одинаковых по форме и энергии гибридных орбиталей.
Метод валентных связей
|
|
|
1. Химическая связь возникает при условии перекрывания атомных орбиталей с антипараллельными спинами.
2. При перекрывании АО электроны в силу своей неразличимости могут переходить с одного атома к другому, т.е атомы могут обмениваться своими е-.
3. За счет обменного воздействия электронная плотность в межмолекулярном пространстве увеличивается на 15-20%, поэтому говорят, что в межъядерном пространстве образовалась и закрепилась общая электронная пара, осуществилась химическая связь, стягивающая ядра.
Способы образования общей электронной пары:
1. Обменный механизм возникновения ковалентной связи путем обобществления неспаренных электронов с антипараллельными спинами от каждого атома.
2. Донорно-акцепторный механизм возникновения ковалентной связи – за счет неподеленной электронной пары одного атома (донор), и вакантной орбитали другого атома (акцептор).
Свойства ковалентной связи, образующейся по механизму 1) или 2) не отличаются.
Свойства веществ с ковалентной связью:
химические связи в реальных веществах имеют, как правило, смешанный характер. Веществ с чисто ковалентной связью немного. Пример: SiO2, Si, C (алмаз, графит)
Свойства: 1)очень твердые и прочные (алмаз)
2) Хрупкие – т.к не выдерживают воздействий приводящих к смещению электронных пар к искожению валентных углов.
3) не проводят электрический ток и тепло. (т.к. нет свободных электронов).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 697; Нарушение авторских прав?; Мы поможем в написании вашей работы!