
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сравнение с механическими смесями
|
|
|
|
Сходство: непостоянство состава.
Различие: однородность.
Растворы занимают промежуточные положение между механическими смесями и химическими соединениями.
Важной характеристикой любого раствора является его состав. Состав раствора можно выражать разными способами – с помощью безразмерных единиц
(долей или %), так и через размерные величины – концентрации.
1. Массовая доля растворенного вещества – безразмерная физическая величина, равная отношению массы растворенного вещества к массе раствора.
т в-ва
С = ω= ------------ ·100 %
↑ т р-ра
массовая
доля
z.B. 5% - ный раствор H2SO4 – в 100г раствора содержится 5г H2SO4 и 95г воды.
т р-ра = т раств.в-ва + т р-ля (воды)
2. Мольная (молярная) доля – отношение количества растворенного вещества к сумме количеств всех веществ, составляющих раствор.
ν раст.в-ва
N = --------------------------
ν в-ва + ν воды
3. Молярная концентрация (молярность) – величина, равная отношению количества растворенного вещества к объему раствора.
ν
С = -----------· 1000
V (мл)
ν в-ва т в-ва
См = ------------ = ------------- [моль/л]
V р-ра(л) µ V р-ра
См (H2SO4) = 5 моль/л или См (HCl) = 1М ← молярность обозначают буквой М
↑
В 1л содержится 5 моль H2SO4
4. Объемная доля.
V в-ва
φ = ----------- · 100%
Vраствора
Готовят растворы с молярной концентрацией в специальных мерных колбах на 50, 100, 200, 250 мл и т.д., где не надо измерять V р-ра.
Если в 1л содержится:
0,1 моль в-ва – децимолярный раствор
0,01 моль в-ва - сантимолярный
0,001моль в-ва - миллимолярный
● Из практики известно, что не все вещества одинаково растворяются в воде. Для характеристики способности вещества растворяться введено понятие растворимость.
По растворимости все вещества делят на три группы:
а) хорошо растворимые – сахар(тв.); гидроксид натрия, спирт, ацетон (жидкие); аммиак (газообр. -700об. в1л); НСl.
б) мало растворимые - гипс; РbSO4; бензол; диэтиловый эфир; метан; азот; О2
в) практически нерастворимые – стекло, серебро, золото, керосин, благородные газы.
Растворимость зависит от природы веществ, температуры, давления.
Растворение кристалла (тв. в-ва) в жидкости: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему V растворителя. Если растворитель соприкасается с большим кол-вом вещества, то через некоторое время раствор становится насыщенным.
● Насыщенный раствор – раствор находящийся в равновесии с растворяющимся веществом (с избытком растворенного вещества)
растворение
 Растворяемое в-во раствор насыщенный
Растворяемое в-во раствор насыщенный
(твердое) кристаллизация
В насыщенных растворах данное в-во при данной температуре больше не растворяется.
Ненасыщенный раствор – раствор, в котором данное вещество может еще растворяться.
Пересыщенный раствор - раствор, содержащий растворенного вещества больше, чем нужно для насыщения при данной температуре (или раствор, содержащий растворенного вещества больше, чем в насыщенном растворе).
Открыты в 1794 г. Ловицем Т.Е. В спокойном состоянии они могут годами оставаться без изменения. Но любое изменение (легкое сотрясение сосуда, введение в р-р кристаллика соли – в-ва, трение о стенки сосуда стеклянной палочки) вызывает выпадение в осадок избытка растворенного вещества (кристаллизация).
Очень легко пересыщенные растворы образуют: сахароза, Na2S2O3 · 5H2O,
Na2SO4 ·10H2O (глауберова соль), Na2В4О7 ·10H2O (бура), СН3СООNa.
Растворимость – это характеристика насыщенного раствора.
Растворимость (коэффициент растворимости) - масса вещества, которая может раствориться в 100 г воды при данной температуре.
Например, растворимость NH4Cl при15о С составляет 35 г. Это значит, что 35 г этой соли при 15о С растворяются в 100 г воды.
Опытно определенные растворимости веществ собраны в кривые растворимости.
По ним легко определить коэффициент растворимости, сколько соли выпадет в осадок при охлаждении раствора. Кривые растворимости показывают зависимость между растворимостью и температурой.
В воде могут быть растворены газы, жидкости, твердые вещества.
Растворение газов в воде представляет экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается. Однако растворение газов в органических жидкостях нередко сопровождается поглощением теплоты, =>
в подобном случае с ростом температуры растворимость газа увеличивается. При растворении газа в жидкости устанавливается равновесие.
Газ + жидкость ↔ насыщенный р-р газа в жидкости
При этом объем с-мы существенно уменьшается => повышение давления приводит к увеличению растворимости газа.
Жидкости могут растворяться в жидкостях. Некоторые неограниченно растворимы друг в друге, другие – до известного предела. С повешением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях.
Температура, при которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения. Например, при t ниже 66,4о С фенол ограниченно растворим в воде, а вода ограниченно растворима в феноле; t=66,4о С - критическая температура растворения для системы вода – фенол, начиная с этой температуры, обе жидкости неограниченно растворимы друг в друге.
Т.к. растворение жидкостей друг в друге не сопровождается значительным изменением объема, то взаимная растворимость жидкостей мало зависит от давления и заметно возрастает лишь при очень высоких давлениях (тысячи атмосфер).
Труднее дело обстоит с твердыми веществами.
При растворении твердых тел в воде объем системы обычно изменяется незначительно. Поэтому растворимость веществ, находящихся в твердом состоянии, практически не зависит от давления.
● Тепловые явления при растворении.
Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты. При растворении в воде NaOH, H2SO4 наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении NH4NO3 – сильное охлаждение раствора, т.е. поглощение теплоты.
Экзотермический процесс – процесс, идущий с выделением энергии.
Эндотермический процесс – процесс, идущий с поглощением энергии.
При растворении твердого вещества в воде происходят следующие явления:
1) разрушение кристаллической решетки (эндотермический процесс);
2) гидратация (сольватация) – соединение молекул растворенного вещества с молекулами растворителя (в данном случае – воды) (экзотермический процесс);
3) диффузия (экзотермический процесс, но очень маленький)
Сравнивают 2 первых процесса:
Q растворения = Q1 + Q2 → сольватация
↑
разрушение
Если | Q1 | > | Q2 |, то процесс идет с поглощением теплоты, эндотермический – растворение NH4NO3 в воде.
Если | Q2 | > | Q1 |, то процесс идет с выделением тепла – экзотермический – * растворение H2SO4 в воде.
Долгое время существовало мнение, что растворение – это физический процесс, происходит лишь распределение молекул растворенного вещества между молекулами растворителя. Это мнение опроверг Д.И. Менделеев. Он создал химическую теорию растворов: между молекулами растворенного вещества и молекулами растворителя происходят химические взаимодействия. Это подтверждает выделение или поглощение тепла при растворении и образование гидратов (гидраты, как правило нестойкие соединения, во многих случаях разлагающиеся при выпаривании р-ров, но иногда выдел-ся из водных растворов в виде кристаллов, содержащих воду).
В-ва, в кристаллы которых входят молекулы воды, называются кристаллогидраты, а содержащаяся в них вода – кристаллизационной.
CuSO4 ·5H2O – медный купорос; Na2SO4 · 10H2O – глауберова соль
Т.о. растворение не только физический, но и химический процесс (физико-химический).
экзо 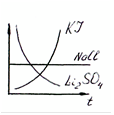
 Li2SO4 1. тв.в-во насыщен. раствор Т ↑ ← растворимость
Li2SO4 1. тв.в-во насыщен. раствор Т ↑ ← растворимость
эндо
эндо
 KI 2. тв.в-во насыщен. раствор Т ↑ →
KI 2. тв.в-во насыщен. раствор Т ↑ →
экзо
NaCl 3. тв.в-во ↔ насыщен. раствор Q ≈ 0
ICl3
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 331; Нарушение авторских прав?; Мы поможем в написании вашей работы!