
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
O с одинаковым осмотическим давлением- изотонический
|
|
|
|
O с меньшим осмотическим давлением — гипотонический,
O Т — абсолютная температура раствора;
o 3 типа растворов по отношению к данному раствору:
o с бóльшим — гипертонический
o В медицинской практике изотоническими растворами называются растворы, осмотическое давление которых равно
o - осмотическому давлению крови = 7,7 атм.
o 0,9% раствор хлорида натрия и
o 4,5-5,0% раствор глюкозы называемые физиологическими р-ми
o - Р онкотич=0.03-0,04атм
o создается белками крови (7-8 %)
o - Р осм. мочи = 8-25 атм
o Осмотическая ячейка - это система, отделенная от окружающей среды мембраной с избирательной проницаемостью
o Эндоосмос происходит, если клетка оказывается в гипотоническом растворе.
o Эндоосмос - движение растворителя в осмотическую ячейку из окружающей среды.
o В результате эндоосмоса вода диффундирует в клетку, происходит набухание клетки с появлением напряженного состояния клетки, называемого тургор.
o -эндоосмос приводит к разрушению клеточной мембраны и лизису клетки (гемолиз эритроцитов крови с выделением гемоглобина в плазму)
o Экзоосмос имеет место, если клетка оказывается в гипертонической среде
o Экзоосмос - движение растворителя из осмотической ячейки в окружающую среду.
o Экзоосмос
o В результате экзоосмоса вода диффундирует из клетки в плазму и происходит сжатие и сморщивание оболочки клетки, называемое плазмолизом
o При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому их концентрацию выражают через осмолярную концентрацию (осмолярностъ)
o Осмолярная концентрация - суммарное молярное количество всех кинетически активных, т. е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
o Осмотическому давлению крови человека соответствует осмолярная концентрация частиц от 275 до 300 мОсм/л.
o Осмолярность считается так:
o 0,1 М NaCl 0.1х 1 + 0.1х1= 0.2 Осм/л= 200 мОсм/л.
o или:
o 0,2М СaCl2 0,2х 1+ 0.2х2= 0.6 Осм/л
• Давление насыщенного пара растворителя
• 3. Давление насыщенного пара растворителя над раствором
• всегда будет меньше давления насыщенного пара над чистым растворителем
• I закон Ф. Рауля (1886):
• При постоянной температуре относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества:
• Dp / p0= x(Z), где Dp = (p0 - p),
• где p - давление паров над раствором, Dp / p0 - относительное понижение давления пара над раствором.
• 4. Температура кипения жидкости - при которой давление насыщенного пара над жидкостью равно внешнему давлению.
• Температура замерзания жидкости - давление насыщенного пара над жидкостью равно давлению насыщенного пара над кристаллами этой жидкости.
• II закон Рауля:
• Повышение температуры кипения или понижение температуры, замерзания идеальных растворов нелетучих веществ прямо пропорционально моляльной концентрации раствора:
• DTк = Kэ b (Х), и
• DTз = Kк b (Х) соответственно,
• где Kэ и Kк – эбуллиоскопическая и криоскопическая константа, соответственно.
• КЭ для воды равна 0,52°С
• КК[вода] = 1,86°С.
• Водно-электролитный баланс
• В зависимости от содержания внеклеточной жидкости
• различают 6 состояний, приводящих к Ý илиß
• Внеклеточной жидкости:
• содержание увеличено в 2 и более раза- гипергидратация
• уменьшено в 2 раза- дегидратация
• 1. Гипертоническая дегидратация:
• Р осм Ý жидкость ß
• при диабете, почечной недостаточности: клетка теряет воду.
• 2.Изотоническая дегидратация –
• Р =N жидкость ß
• страдает внеклеточное пространство- при потере крови.
• 3.Гипотоническая дегидратация
• Р осм ß жидкость ß
• клетка пересыщается водой – при потери натрия, который удерживает воду.
• 4. Гипертоническая гипергидратация
• Р осм Ý жидкость Ý
• клетка обезвоживается- если нет пресной воды
• 5. Изотоническая гипергидратация
• Р =N жидкость Ý
• отеки при циррозе печени, ССЗ
• 6. Гипотоническая гипергидратация
• Р осм ß жидкость Ý
• чрезмерное потребление воды, поражаются клетки
• Равновесие между раствором и осадком малорастворимого сильного электролита.
• Са3(РО4)2 ↓↔ 3Са 2+ + 2PO4 3-.
• Применяя закон действующих масс для данного равновесного состояния, выразим константу растворимости КS (произведение растворимости (ПР)):
• ПР = [Са 2+ ] 3[PO4 3- ]2 / [Са3(РО4)2 ].
• [Са3(РО4)2 ] = const, и ПР(Са3(РО4)2)= [Са 2+ ] 3[PO4 3- ]2.
• Чем меньше ПР, тем ниже растворимость электролита.
• Условия образования осадка: стехиометрическое произведение концентраций ионовсильного электролита должно быть больше ПР:
• [Са 2+ ] 3[PO4 3- ]2 > ПР.
• Условия растворения осадка: осадок малорастворимого сильного электролита растворится, когда стехиометрическое произведение концентраций ионовсильного электролита меньше ПР:
• [Са 2+ ] 3[PO4 3- ]2 < ПР.
• Последовательность осаждения ионов: если к раствору, содержащему смесь ионов, осаждаемых одним и тем же реагентом, добавить этот реагент, то образование осадков идет поочередно, начиная с электролита, имеющего наименьшее ПР.
В живых организмах присутствуют комплексные соединения биогенных металлов:Л№4
- с белками,
- витаминами и др.
- комплексные соединения играют роль
- ферментов
- выполняют специфические функции в обмене веществ.
u Характерной особенностью комплексных соединений является наличие в них химической связи, возникшей по донорно-акцепторному механизму:
• Комплексные соединения - устойчивые химические соединения сложного состава, в которых обязательно имеется хотя бы одна связь, возникшая по донорно-акцеп-торному механизму.
• В каждом комплексном соединении различают внутреннюю и внешнюю сферы:
• K 3+ [Al(OH)6]-3 [Сu(NH3)4]+2 (NO3)2
• Комплексообразователь (центральный атом) - атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении.
• Роль комплексообразователя выполняют
• -----атомы или ионы d- и f-металлов;
• -----Атомы неметаллов с различной положительной степенью окисления: В +3, S +6, S +4.
• ---- Отрицательно заряженные ионы неметаллов: N 3–, I –, S 2–.
• Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число- оно равно удвоенному заряду иона комплексообразователя.
• 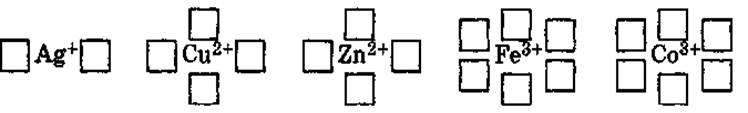
• В комплексных соединениях комплексообразователь связан с лигандами.
u Лиганды - молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем.
u Лиганды-анионы:
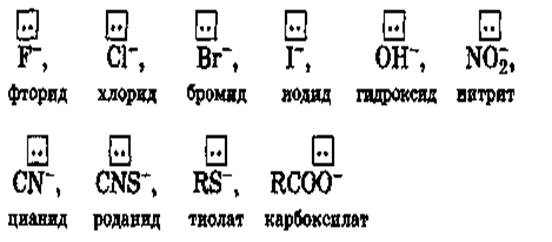
Лиганды-молекулы
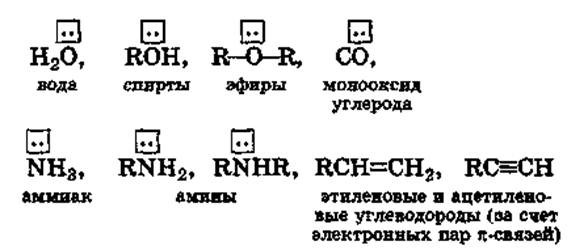
• По числу связей, образуемых лигандом с комплексообразо-вателем, лиганды делятся на моно-, би- и полидентатные
• Внешняя сфера комплексного соединения — это положительно или отрицательно заряженные ионы, нейтрализующие заряд комплексного иона и связанные с ним ионной связью

• Теории строения комплексных соединений.
• 1. С точки зрения электростатической теории В.Косселя и А.Магнуса образование комплексных соединений обусловлено действием кулоновских сил-притяжением между центральным катионом металла и анионами или полярными молекулами лигандов
• ---- не объясняла многие свойства комплексных соединений — магнитные свойства, окраску, реакционноспособность
• 2. В 1891 г. швейцарский учёный Альфред Вернер предложил координационную теорию комплексных соединений, которая легла в основу и современных представлений.
• 3. теории кристаллического поля.
• - лиганды создают электростатическое поле, под действием которого меняется энергия электронных орбиталей центрального иона. При этом меняется распределение электронов. На орбиталях центрального атома освобождаются места для электронов лиганда. Освободившиеся орбитали используются для образования донорно-акцепторной связи с лиганд
• Метод валентных связей.
• --Связь между центральным атомом и лигандами донорно-акцепторная. Лиганды предоставляют электронные пары, а ядро — свободные орбитали.
• -----Мерой прочности служит степень перекрывания орбиталей. Обобществление электронных пар донора и акцептора сопровождается выделением энергии.
• Так как запас энергии уменьшается, связь становится устойчивой.
• ----Донорно-акцепторная связь характеризуется направленностью, отсюда конфигурация комплексного иона строго определённая.
• -----Строение и прочность комплекса зависят от характера орбиталей, участвующих в гибридизации
• Классификация комплексных соединений.
• I тип: комплексные соединения с одинаковыми лигандами называются однородными, а с разными лигандами — неоднородными.
• II тип: за основу берётся химическая природа комплекса [комплексы катионные, анионные, нейтральные].
• III тип: наиболее распространена классификация по химической природе лигандов.
• 1. Аммиакаты —: [Ag(NH3)2]Cl.
• 2. Ацидокомплексы: лиганды — анионы кислот: К3[Fe(CN)6].
• 3. Аквакомплексы — лигандами являются молекулы воды: [Со(Н2О)6]SО4.
• 4. Гидроксокомплексы — лигандами являются гидроксогруппы: К3[Al(ОН)6].
• 5. Сверхкомплексные соединения: число лигандов превышает координационное число:
• [Cu(H2O)4]SO4 • H2O
• 6. Внутрикомплексные соединения: Комплексообразователь как бы втянут внутрь лиганда [хелат — «клешня рака»]. лиганды — сложные молекулы, образующие с комплексообразователем помимо донорно-акцепторной связи, ещё ковалентные связи:
• H2C—H2N NH2—CH2
• Cu
• O=C—O O—C=O
• В живых организмах в полидентных лигандах донорные атомы связаны в единое кольцо-цикл.
• - порфирины [железо в гемоглобине, магний в хлорофилле, кобальт в витамине В 12 ].
• Полидентные лиганды связываются с ионами металла гораздо сильнее, чем монодентные с теми же донорными атомами [прочность комплексов на 8–10 порядков выше].
• Повышенная прочность комплексных соединений с полидентными лигандами называется хелатным эффектом.
• Чем выше заряд ионов-комплексообразователей и выше основность лигандов, тем выше хелатный эффект.
• Хелатный эффект снижается, если ион сильно гидратирован и имеет малый радиус.
• Так как ионы Н + конкурируют с ионами металла, повышение кислотности среды снижает хелатный эффект.
• Международная (Женевская) номенклатура КС
• I. КС разбивается на внешнюю и внутреннюю сферы. вначале дается название аниона, а потом катиона:
• II. Комплекс называется следующим образом:
• а) сначала перечисляются лиганды с указанием их числа в комплексе;
• б) лигнады-анионы называются с добавлением окончания ”о”:OH- - гидроксо, F- - фторо и т.д.
• г) нейтральные лиганды называются так же как молекулы: Cl2 - хлор, и т.д. (исключения: H2O - аква, NH3 - аммин, CO
• после перечисления лигандов дается название комплексообразователя с указанием его заряда:.
• --- Катионный комплекс - по-русски в родит. падеже:
• [Co+2(H2O) 06]SO4 -2 - сульфат гексааквакобальта (+2);
• --- анионный комплекс то название комплексообразователя - по-латыни с окончанием “ат”:
• K3[Fe+3(CN) -1 6] - гексацианоферрат (+3) калия.
• ---- если комплекс не заряжен, то комплексообразователь называется по-русски в именительном падеже:
• [Fe0(CO)0 5] - пентакарбонилжелезо;
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 631; Нарушение авторских прав?; Мы поможем в написании вашей работы!