
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость реакции
|
|
|
|
Скорость химической реакции – это изменение концентрации (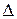 C) реагирующих веществ за единицу времени(
C) реагирующих веществ за единицу времени(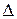 t)
t)
Vср = ±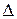 с/
с/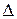 t.
t.
Знак «+» ставится, если скорость контролируется по образующемуся продукту, а знак «–» — по расходу исходного вещества.
 По результатам измерений концентраций во времени строят так называемые кинетические кривые.
По результатам измерений концентраций во времени строят так называемые кинетические кривые.
Например, в ходе реакции А ® В концентрация исходного вещества А уменьшается, а продукта реакции В – увеличивается и кинетическая кривая имеет вид(рисунок 1).
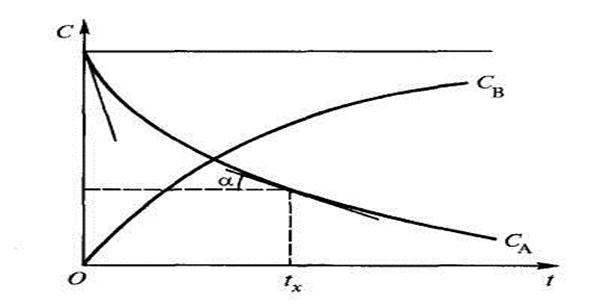
Рисунок 1 Кинетические кривые расходования исходного вещества А и образования продукта реакции В
В зависимости от количества фаз все системы и протекающие в них реакции делятся на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе. Например, реакция взаимодействия между хлором и водородом, приводящая к образованию хлороводорода, является гомогенной так как все вещества находятся в газообразном состоянии
Cl2(г) + H2(г) = 2HCl(г).
Гетерогенные реакции протекают на поверхности раздела фаз. Примером гетерогенной реакции может служить реакция горения, протекающая на границе уголь-кислород (система, состоящая из двух фаз)
С(к) + О2(г) = СО2(г).
2 Факторы, влияющие на скорость химических реакций
Основные факторы, влияющие на скорость реакции:
1) Природа реагирующих веществ,
2) Концентрация реагирующих веществ,
3) Температура,
4) Наличие посторонних веществ.
2.1 Природа реагирующих веществ
С увеличением концентрации скорость реакции возрастает, так как чаще происходят столкновения молекул реагирующих веществ. Количественно эта зависимость определяется законом действующих масс.
Закон действующих масс (1867г.) — скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для гомогенной реакции mА + пВ = С
уравнение скорости реакции имеет вид

Входящая в уравнение константа скорости К — это скорость реакции при концентрациях реагирующих веществ равных единице.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Пример
Напишем выражение закона действующих масс для следующих реакций:
1) N2(г) + 3H2(г) = 2NH3(г);
2) 2C(к) + O2(г) = 2CO(г).
Решение
1) Данная система являться гомогенной, поэтому в формулу закона действующих масс будут входить концентрации всех компонентов:
u=[N2]·[H2]3;
2) Данная система являться гетерогенной, поэтому в формулу закона действующих масс будут входить концентрации только газообразных веществ
u=[О2].
2.2 Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 262; Нарушение авторских прав?; Мы поможем в написании вашей работы!