
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислород
|
|
|
|
Введение
Р-ЭЛЕМЕНТЫ VI ГРУППЫ
К р-элементам VI группы относятся кислород (О), сера (S), селен (Sе), теллур(Те), полоний (Ро).
На рисунке 2 приведены энергетические диаграммы валентных зон данных элементов в основном и возбужденном состояниях.
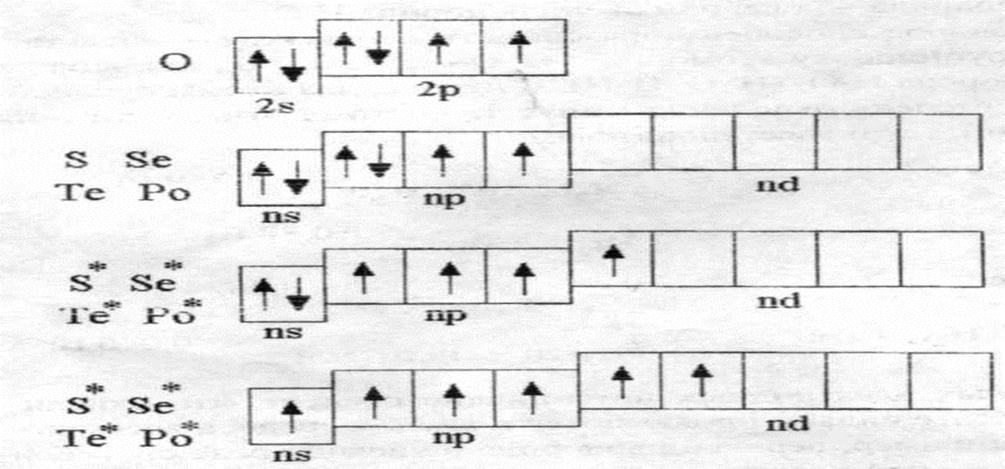
Рисунок 2. Энергетические диаграммы валентных зон р-элементов VI группы
Из приведенного рисунка видно, что на внешнем электронном слое атомов рассматриваемых элементов находится шесть электронов и они могут проявлять четные валентности 2, 4, 6. У атома кислорода отсутствует d-подуровень, поэтому возбужденные состояния отсутствуют и валентность кислорода равна только 2.
Все элементы данной подгруппы, за исключением полония, неметаллы.
Кислород является самым распространённым элементом земной коры. Молекула кислорода двухатомна (О2). Простое вещество - молекулярный кислород - представляет собой газ без цвета и запаха, плохо растворимый в воде. В воздухе содержится 21 % (по объёму) кислорода. В природных соединениях кислород встречается в виде оксидов (Н2О, SiО2) и солей кислородных кислот. Промышленный способ получения кислорода – ректификация жидкого воздуха. Хранят в жидком состоянии воздух, азот и кислород хранят в сосудах Дъюара.
Кислород играет важную роль в природе. Он участвует в жизненно важном процессе – дыхании. Применение его разнообразно. Производство серной и азотной кислот, выплавка металлов, получение высоких температур и т.д.
Аллотропной модификацией кислорода является озон (O3). Озон - один из сильнейших окислителей; по окислительной активности он уступает только фтору. Он окисляет все металлы, кроме золота и платиновых металлов, а также большинство неметаллов. В стратосфере земли образует озоновый слой, поглощающий основную часть ультрафиолетового излучения. Для обнаружения озона применяется следующая реакция
2КI + О3+Н2О = I2 + 2КОН + О2.
Важным соединением кислорода является Н2О2 – пероксид водорода (Н–О–О–Н). Атомы кислорода находятся в промежуточной степени окисления -1 и поэтому могут проявлять как окислительные, так и восстановительные свойства:
Н2О2 + 2КI = I2 + 2КОН
2О-1 + 2 е = 2О-2,
2I- - 2е = I2;
5Н2О2 + 2КМnО4 + 3Н2SО4 = 5О2 + 2Мn SО4 + К2SО4 + 8Н2О
2О-1 - 2 е = О2,
2 Мn+7 + 5е = Мn+2.
Пероксид водорода в кислой среде способен окислять вещества, стандартный электродный потенциал которых не превышает +1,776 В, и восстанавливать только те, у которых потенциал больше +0,682 В.
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 379; Нарушение авторских прав?; Мы поможем в написании вашей работы!